Por ejemplo: hexafluoruro de dinitrógeno. El primer elemento es nitrógeno y el símbolo químico del nitrógeno es N. 
Por ejemplo: Dinitrogen tiene el prefijo `di-` que significa 2; Así que hay dos átomos de nitrógeno presentes. Escribe dinitrógeno como N2. 
Por ejemplo: hexafluoruro de dinitrógeno. El segundo elemento es el flúor. Simplemente omita la terminación `-ide` para obtener el nombre real del elemento. El símbolo químico del flúor es F. 
Por ejemplo: hexafluoruro tiene el prefijo `hexa-` que significa 6; Por eso hay 6 átomos de flúor presentes. Escribe hexafluoruro como F6. La fórmula química final para el hexafluoruro de dinitrógeno es N2F6. 
Dióxido de azufre: SO2 Tetrabromuro de carbono: CBr4 Pentóxido de difósforo: P2O5 

Solo hay 3 cationes poliatómicos, y estos son amonio (NH4), hidronio (H3) y mercurio (I) (Hg2 El resto de los iones poliatómicos tienen cargas negativas que van desde -1 a -4. Algunos ejemplos comunes son el carbonato (CO3), sulfato (SO4), nitrato (NO3) y cromato (CrO4). 
Todos los elementos del grupo 1 son 1+. Todos los elementos del grupo 2 son 2+. Los elementos de transición tienen números romanos para indicar su carga. La plata es 1+ El zinc es 2+ y el Aluminio es 3+. El grupo 17 es 1-. El grupo 16 es 2-. El grupo 15 es 3-. Recuerde que cuando se trata de iones poliatómicos, puede aprovechar la carga del ion. 
Por ejemplo: óxido de litio. El litio es un elemento del grupo 1 y tiene una carga de 1+. El oxígeno es un elemento del grupo 16 y tiene una carga de 2-. Para equilibrar la carga 2- de oxígeno, necesitas 2 átomos de litio; Por lo tanto, la fórmula química del óxido de litio es Li2O. 
Nitruro de calcio: el símbolo del calcio es Ca y el símbolo del nitrógeno es N. Ca es un elemento del grupo 2 y tiene una carga de 2+. El nitrógeno es un elemento del grupo 15 y tiene una carga de 3-. Para equilibrar esto, necesitas 3 átomos de calcio (6+) y 2 átomos de nitrógeno (6-): Ca3norte2. Fosfato de mercurio (II): el símbolo del mercurio es Hg y el fosfato es el ion poliatómico PO PO4. Mercurio tiene una carga de 2+ como lo indica el número romano II junto a él. El fosfato tiene una carga de 3-. Para equilibrarlos, necesitas 3 átomos de mercurio (6+) y 2 moléculas de fosfato (6-): Hg3(CORREOS4)2. 

Recuerde equilibrar las cargas al formar nuevos compuestos. Por ejemplo: AgNO3 + NaCl --> ? Ag ahora está acoplado a Cl para formar AgCl. Na ahora está vinculado a NO3 a NaNO3 Dar forma. 
Por ejemplo: AgNO3 + NaCl --> ? AgNO3 + NaCl --> AgCl + NaNO3 
Por ejemplo: AgNO3 + NaCl --> AgCl + NaNO3 Cuente el número de átomos en ambos lados: 1 Ag a la izquierda, 1 Ag a la derecha; 1 N izquierda, 1 N derecha; 3 O izquierda, 3 O derecha; 1 después de la izquierda, 1 después de la derecha; 1 cl a la izquierda, 1 cl a la derecha. Esta ecuación de reacción está en equilibrio porque hay el mismo número de átomos en los lados izquierdo y derecho de la ecuación. 
NiCl2 + (NUEVA HAMPSHIRE4)2s --> ? Cationes: Ni y NH4 Aniones: Cl y S Reorganizar los iones para crear nuevos productos: NiS + NH4cl Escribe la ecuación: NiCl2 + (NUEVA HAMPSHIRE4)2s --> NiS + NH4cl Balancee la ecuación: NiCl2 + (NUEVA HAMPSHIRE4)2s --> NiS + 2NH4cl
Haciendo una ecuacion quimica
Contenido
Una buena manera de pensar en una reacción química es el proceso de hornear galletas. Mezclas los ingredientes (harina, mantequilla, sal, azúcar y huevos), horneas la masa y ves que se convierte en algo nuevo. Galletas. En términos químicos, la receta es la ecuación, los ingredientes son los `reactivos` y las galletas son los `productos`. Todas las ecuaciones de reacción se parecen a `A + B --> do (+ re..)`, donde cada letra mayúscula es un elemento o una molécula (una colección de átomos unidos por enlaces químicos). La flecha indica la reacción o cambio que se está produciendo. Para escribir las ecuaciones, hay algunas reglas de nomenclatura importantes que deberá conocer.
Pasos
Parte 1 de 3: escribir fórmulas químicas de enlaces covalentes

1. Aprende los prefijos para el número de átomos. Al nombrar compuestos, se utilizan prefijos griegos para indicar el número de átomos presentes en cada elemento. Los enlaces covalentes tienen el primer elemento escrito en su totalidad, mientras que el segundo elemento tiene el sufijo `-uro`. Por ejemplo, el trisulfuro de pentóxido de difósforo tiene la fórmula química P2s3. Estos son los prefijos del 1 al 10:
- 1: Mono-
- 2: di-
- 3: tres-
- 4: tetra-
- 5: Penta-
- 6: hexagonal-
- 7: Hepta-
- 8: octava-
- 9: Nona-
- 10: Dec-

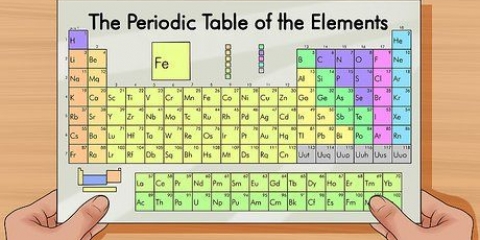
2. Escribe el símbolo químico del primer elemento. Cuando se escribe un compuesto, es necesario indicar los elementos y conocer sus símbolos químicos. El primer elemento que se escribe es el `nombre de pila` de la composición. Usa la tabla periódica para encontrar el símbolo químico de un elemento.

3. Agregar el número de átomos como subíndice. Para identificar el número de átomos presentes para cada elemento, todo lo que necesita hacer es mirar el prefijo del elemento. Memorizar los prefijos griegos te ayudará a escribir fórmulas químicas rápidamente, sin tener que buscar nada.

4. Escribe el símbolo químico del segundo elemento. El segundo elemento es el `apellido` de la sustancia y sigue al primer elemento. En los enlaces covalentes, los nombres de los elementos tienen el sufijo `-uro` en lugar de la terminación normal del elemento.

5. Agregue en subíndice el número de átomos presentes. Al igual que con el primer elemento, determina el número de átomos en el segundo elemento leyendo el prefijo. Con este prefijo se escribe el número de átomos como subíndice a la derecha del símbolo químico.

6. Practica con algunos ejemplos. Si recién está comenzando con la química, hay mucho que memorizar. Es como aprender un nuevo idioma. Cuanto más practiques con problemas de muestra, más fácil será descifrar fórmulas químicas en el futuro y aprender el lenguaje de la química.
Parte 2 de 3: escribir fórmulas químicas de enlaces iónicos

1. Determinar los símbolos químicos de los cationes y aniones. Todos los productos químicos tienen nombre y apellido. El primer nombre es el catión (ion positivo) mientras que el apellido es el anión (ion negativo). Los cationes se escriben como nombre del elemento mientras que los aniones son el nombre del elemento que termina con el sufijo `-uro`.
- El símbolo químico de cada elemento se encuentra en la tabla periódica.
- A diferencia de los enlaces covalentes, los prefijos griegos no se utilizan para indicar el número de átomos de cada elemento. Hay que equilibrar las cargas de los elementos, para determinar el número de átomos.
- Por ejemplo: el óxido de litio es Li2O.

2. Reconocer iones poliatómicos. A veces, el catión o el anión es un ion poliatómico. Son moléculas que contienen dos o más átomos con grupos iónicos. No hay truco para recordar esto, solo tendrás que memorizarlos.

3. Determinar la valencia de cada elemento. La valencia se puede determinar observando la posición del elemento en la tabla periódica. Hay algunas reglas a tener en cuenta que pueden ayudarlo a determinar las cargas:

4. Equilibrar las cargas positivas y negativas de los iones. Una vez que haya determinado la carga de cada elemento (o ión poliatómico), usará estas cargas para determinar la cantidad de átomos presentes en cada elemento. La intención es establecer la carga del compuesto en cero, por lo que agregará átomos para equilibrar las cargas.

5. Practica con algunos ejemplos. La mejor manera de aprender a escribir fórmulas es practicar con muchos ejemplos. Use ejemplos en su libro de texto de química o busque en línea ejercicios de práctica. Haz todo lo que puedas hasta que domines la escritura de fórmulas químicas.
Parte 3 de 3: determinar los productos de los reactivos dados

1. Determinar todos los cationes y aniones en los reactivos. En la ecuación de una simple ecuación de reemplazo doble, hay dos cationes y aniones. La ecuación general está en la forma de AB + CD --> AD + CB, donde A y C son cationes y B y D son aniones. Determine también la carga de cada ion.
- Por ejemplo: AgNO3 + NaCl --> ?
- Los cationes son: Ag. Los aniones son: NO3 y Cl.

2. Intercambiar los iones para crear los productos. Una vez que haya determinado todos los iones y sus cargas, colóquelos de modo que el primer catión esté enlazado con el segundo anión y el segundo catión esté enlazado con el primer anión. Recuerda la ecuación: AB + CD --> DA + CB.

3. Escribe la ecuación completa. Después de escribir los productos que se forman en la ecuación, puedes escribir la ecuación completa tanto con los productos como con los reactivos. Coloque los reactivos en el lado izquierdo de la ecuación y escriba los nuevos productos en el lado derecho, con un signo más en el medio.

4. trae la ecuacionen balance. Una vez que haya escrito la ecuación y determinado todos los productos y reactivos, asegúrese de que todo esté en equilibrio. Una ecuación solo está en equilibrio cuando hay el mismo número de átomos de cada elemento en ambos lados.

5. Practica con algunos ejemplos. La única forma de mejorar en la escritura de ecuaciones es practicarlas. Trabaje con los siguientes ejemplos para asegurarse de que realmente comprende el proceso.
Artículos sobre el tema. "Haciendo una ecuacion quimica"
Оцените, пожалуйста статью
Popular