En esta fórmula, norte el numero de moles, pags la presión, V El volumen, t la temperatura en Kelvin y R la constante de los gases. Ejemplo: n=PV/RT=(0,984 atm x 1 L) / (0,08206 L atm mol-1 K-1 x 318,15 K)=0,0377 mol 
Ejemplo: 14,42 g / 0,0377 mol=382,49 g/mol 
Ejemplo: (12,0107g x 12) + (15,9994g x 1) + (1,00794g x 30)=144,1284 + 15,9994 + 30,2382=190,366g 
Ejemplo: 382,49 / 190,366=2,009 
Ejemplo: C12OH30 x 2=C24O2H60 

Ejemplo: 75,46 g C x (1 mol / 12,0107 g)=6,28 mol C 8,43 g O x (1 mol / 15,9994 g) = 0,53 mol O 16,11 g H x (1 mol / 1,00794) = 15,98 mol H 
Ejemplo: La cantidad molar más pequeña es oxígeno con 0,53 mol. 6,28 mol/0,53 mol=11,83 0,53 mol/0,53 mol=1 15,98 mol/0,53 mol=30,15 
Ejemplo: la fórmula de la relación se convierte en C12OH30 11.83=12 1=1 30.15=30 


Determinación de la fórmula molecular de una sustancia
Contenido
La fórmula molecular es una pieza importante de información sobre un químico. La fórmula molecular indica qué átomos están presentes en la sustancia y cuántos de cada uno. Necesita la fórmula de la relación para calcular la fórmula molecular y también necesita saber que la diferencia entre estas dos fórmulas es un número entero.
Pasos
Parte 1 de 3: derivación de la fórmula molecular a partir de una fórmula de proporción

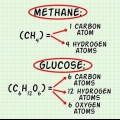
1. Conocer la relación entre la fórmula molecular y la fórmula de la razón. La fórmula de la proporción dice algo sobre la proporción de átomos dentro de una molécula, por ejemplo, dos átomos de oxígeno en cada átomo de carbono. La fórmula molecular te dice cuánto de cada uno de estos átomos está presente en la molécula. Por ejemplo, un átomo de carbono y dos de oxígeno (dióxido de carbono). Estas dos fórmulas se relacionan entre sí por un número entero de tal manera que si la fórmula de la razón se multiplica por esa razón, resultará la fórmula molecular.

2. Calcular el número de moles de gas. Esto significa que usas la ley de los gases ideales. Puede determinar el número de moles en función de la presión, el volumen y la temperatura según lo proporcionado por los datos de los experimentos. El número de moles se puede calcular mediante la fórmula: n=PV/RT.

3. Calcular la masa molecular del gas. Esto solo se puede hacer cuando se conoce el número de moles presentes en el gas, utilizando la ley de los gases ideales. También necesitará saber cuántos gramos de un gas hay. Luego divida el número de gramos de gas por el número de moles del gas presente, para determinar la masa molecular.

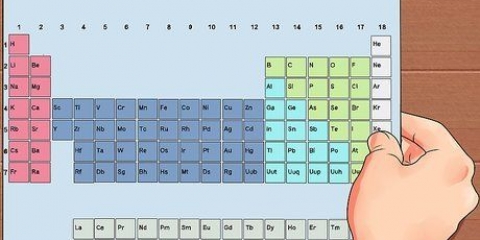
4. Sume las masas atómicas de todos los átomos en la fórmula de la relación. Cada átomo en la fórmula de la razón tiene su propia masa atómica. Este valor se puede encontrar en la parte inferior del cuadro de ese elemento, en la tabla periódica. Sume estas masas para obtener la masa de la fórmula de la razón.

5. Determinar la relación entre la masa molecular y la de la fórmula de la relación. Esto le permite determinar con qué frecuencia la masa entra en la molécula real de acuerdo con la fórmula de proporción. Si sabes esto, entonces también sabes cuántas veces la fórmula de la razón entra en la fórmula molecular. Esto debe ser un número entero. Si la razón no es un número entero, entonces tienes que redondearlo.

6. Multiplica la fórmula de la razón por la razón. Multiplica los subíndices de la fórmula de la razón por la razón. Esto te dará la fórmula molecular. Tenga en cuenta que para cualquier sustancia con una proporción de `1`, la fórmula de la proporción y la fórmula molecular serán las mismas.
Parte 2 de 3: Determinar la fórmula de la razón

1. Determinar la masa de cada átomo presente. A veces se dará la masa de cada átomo. En otro momento, solo se da la masa en porcentaje. Si este es el caso, suponga que se trata de una muestra de 100 g de la sustancia. Con esto puedes escribir el porcentaje de masa como masa real en gramos.
- Ejemplo: 75,46 g C, 8,43 g O, 16,11 g H

2. Convertir las masas al número de moles. Necesitas convertir la masa molecular de cada elemento en mol. Para hacer esto, divida la masa molecular por la masa atómica de cada elemento respectivo. Puedes encontrar la masa atómica en la parte inferior del cuadro de ese elemento en la tabla periódica.

3. Divide cada valor molar por el valor molar más pequeño. Debe dividir los moles de cada elemento individual por la cantidad molar más pequeña de todos los elementos presentes en el compuesto. Le permite determinar las proporciones molares más simples. Esto es válido porque el elemento presente en menor cantidad se establece en `1` y da las proporciones respectivas de los otros elementos en el compuesto.

4. Redondea los valores molares a números enteros. Estos números se convierten en los subíndices de la fórmula de la razón. Redondea al número entero más próximo. Después de determinar estos números, puede escribir la fórmula de la razón.
Parte 3 de 3: Comprende la fórmula química

1. Comprender cómo funciona una fórmula de proporción. Una fórmula de proporción le brinda información sobre la proporción de un átomo a otro en una molécula. Esto no le da ninguna información sobre cuántos átomos están exactamente presentes en la molécula. La fórmula de la proporción tampoco te da ninguna información sobre la estructura y el enlace de los átomos en una molécula.

2. Sepa lo que le dice una fórmula molecular. Al igual que la fórmula de la proporción, la fórmula molecular no brinda información sobre el enlace y la estructura de una molécula. Pero a diferencia de la fórmula de la proporción, la fórmula molecular le brinda información sobre la cantidad de cada átomo presente en la molécula. La fórmula de la razón y la fórmula molecular se relacionan entre sí según una razón entera.

3. Comprender fórmulas estructurales. Las fórmulas estructurales proporcionan incluso más información que las fórmulas moleculares. Además de indicar la cantidad de átomos en una molécula, las fórmulas estructurales también brindan información sobre los enlaces y la estructura de la molécula. Esta información es crucial para comprender cómo reaccionará la molécula.
Consejos
- Lea la declaración (o los datos) cuidadosamente.
Advertencias
- No confundas la fórmula de la razón y la fórmula molecular.
Artículos de primera necesidad
- Tabla Periódica de los Elementos
- Calculadora
- Lápiz
- Papel
Artículos sobre el tema. "Determinación de la fórmula molecular de una sustancia"
Оцените, пожалуйста статью
Similar
Popular