En química, los términos significan "oxidación" y "reducción" aquellas reacciones en las que un átomo (o un grupo de átomos) pierde o gana electrones respectivamente. Los números de oxidación son números asignados a los átomos (o grupos de átomos) para ayudar a los químicos a verificar cuántos electrones están disponibles para ser desplazados y si los reactivos dados se oxidan o reducen durante una reacción. El proceso de asignación de números de oxidación a los átomos puede variar de muy simple a más complejo, dependiendo de la carga de los átomos y la composición química de las moléculas de las que forman parte. Para complicar las cosas, algunos átomos pueden tener múltiples números de oxidación. Afortunadamente, la asignación de números de oxidación se rige por reglas bien definidas y fáciles de seguir, pero una comprensión básica de la química y el álgebra hará que usar estas reglas sea mucho más fácil.
Pasos
Parte 1 de 2: asignación de números de oxidación según las reglas químicas
1.
Determinar si la sustancia en cuestión es elemental. Los átomos libres, no unidos, siempre tienen un número de oxidación de 0. Esto es cierto tanto para los átomos que consisten en un solo átomo como para los átomos cuya forma elemental es diatómica o poliatómica.
- Por ejemplo, Al(s) y Cl2 ambos tienen el número de oxidación 0 porque no son átomos compuestos.
- Tenga en cuenta que el azufre en su forma elemental, S8 (octasulfuro), aunque irregular, también tiene un número de oxidación de 0.
2. Determinar si la sustancia en cuestión es un ion. Los iones tienen números de oxidación iguales a su carga. Esto es cierto tanto para los iones libres como para los iones que forman parte de un ion compuesto.
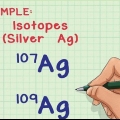
Por ejemplo, el ion Cl tiene un número de oxidación -1.El ion Cl todavía tiene un número de oxidación de -1 cuando es parte del compuesto NaCl. Dado que el ion Na, por definición, tiene una carga de +1, sabemos que el ion Cl tiene una carga de -1, por lo que el número de oxidación sigue siendo -1.3. En el caso de los iones metálicos, es bueno recordar que son posibles múltiples números de oxidación. Muchos metales pueden tener más de un descanso. Por ejemplo, el metal hierro (Fe) puede ser un ion con carga +2 o +3. la carga de los iones metálicos (y por lo tanto también de sus números de oxidación) puede determinarse en relación con la carga de los otros átomos en la composición de la que forman parte o, cuando se escribe como texto, mediante la notación en números romanos (como como en el sentido: "El ion hierro(III) tiene una carga de +3.").
Por ejemplo, examinemos un compuesto que contiene un ion de aluminio. El compuesto AlCl3 tiene carga 0. Como sabemos que los iones Cl tienen una carga de -1 y hay 3 iones Cl en el compuesto, el ion Al debe tener una carga de +3, de modo que la carga de todos los iones sumados es 0. Entonces, el número de oxidación de Al es +3.4. Asigne un número de oxidación -2 al oxígeno (con excepciones). En casi todos los casos los átomos de oxígeno tienen un número de oxidación de -2. Hay algunas excepciones a esta regla:
Cuando el oxígeno está en estado elemental (O2), entonces el número de oxidación es 0, que es el caso de todos los átomos elementales.Cuando el oxígeno es parte de peróxido, entonces el número de oxidación es -1. Los peróxidos son una clase de sustancias compuestas que tienen un enlace oxígeno-oxígeno (o el anión peróxido O2). Por ejemplo, en la molécula H2O2 (peróxido de hidrógeno), el oxígeno tiene un número de oxidación (y una carga) de -1.Además, cuando el oxígeno es parte de un superóxido, el número de oxidación -0.5 es.Cuando el oxígeno se une al flúor, el número de oxidación es +2. Consulte la regla del flúor a continuación para obtener más información. en (O2F2) es esto +1.5. Asigne un número de oxidación de +1 al hidrógeno (con excepciones). Al igual que ocurre con el oxígeno, el número de oxidación del hidrógeno depende de casos excepcionales. En general, el hidrógeno tiene un número de oxidación +1 (excepto en forma elemental, H2). Pero en el caso de un compuesto especial llamado híbrido, el hidrógeno tiene un número de oxidación de -1.
Por ejemplo, de H2Oh, sabemos que el hidrógeno tiene un número de oxidación de +1 porque el oxígeno tiene una carga de -2 y necesitamos 2 +1 cargas para hacer un compuesto con una carga total de cero. Pero en el caso del hidruro de sodio, NaH, el hidrógeno tiene un número de oxidación de -1 porque el ion Na tiene una carga de +1 y, para que la carga total del compuesto sea 0, el hidrógeno tiene una carga (y por lo tanto un número de oxidación ) de - 1.
6. El flúor tiene siempre un número de oxidación de -1. Como se mencionó anteriormente, los números de oxidación de ciertos elementos pueden variar debido a varios factores (iones metálicos, átomos de oxígeno en peróxidos, etc.).). El flúor, por otro lado, tiene un número de oxidación de -1, y eso nunca cambia. Esto se debe a que el flúor es el elemento más electronegativo, o en otras palabras, es el elemento menos dispuesto a ceder electrones y con más probabilidades de tomar electrones de otros átomos. Por lo tanto, el número de oxidación no cambiará.
7. Los números de oxidación de un compuesto son iguales a la carga del compuesto. Los números de oxidación de todos los átomos en un compuesto son iguales a la carga de ese compuesto. Por ejemplo, si un compuesto no tiene carga, entonces la suma de todos los números de oxidación será cero; si el compuesto es un ion poliatómico con una carga de -1, entonces los números de oxidación sumados deben ser iguales a -1, etc.
Esta es una buena manera de verificar su respuesta: si los números de oxidación de un compuesto no suman la carga de ese compuesto, entonces sabe que ha cometido un error.Parte 2 de 2: Asignación de números a los átomos sin las reglas del número de oxidación
1.
Encuentra átomos sin reglas de número de oxidación. Algunos átomos no siguen las reglas para encontrar los números de oxidación. Si un átomo no cumple con las reglas anteriores y no está seguro de cuál es su carga (por ejemplo, si es parte de un compuesto más grande y se desconoce la carga individual), entonces puede encontrar el número de oxidación de ese átomo por eliminación. Primero determinas la oxidación de cada otro átomo en el compuesto. Luego, resuelve la suma de la incógnita en la ecuación, según la carga total del compuesto.
- Por ejemplo, en el compuesto Na2ENTONCES4, se desconoce la carga de azufre (S) - no está en la forma elemental, por lo que no es 0, pero eso es todo lo que sabemos. Este es un buen candidato para aplicar este método para determinar algebraicamente el número de oxidación.

2. Determine los números de oxidación conocidos de los otros elementos en el compuesto. Usando las reglas de asignación de números de oxidación, determinamos qué números de oxidación tienen los otros átomos en el compuesto. Tenga en cuenta las excepciones como O, H, etc.
en nac2ENTONCES4, sabemos, con base en nuestro conjunto de reglas, que el ion Na tiene una carga (y por lo tanto un número de oxidación) de +1 y que los átomos de oxígeno tienen un número de oxidación de -2.3. Multiplica el numero de cada atomo por el numero de oxidacion. Ahora que conocemos los números de oxidación de todos los átomos excepto el desconocido, tendremos que considerar que algunos de estos átomos pueden aparecer más de una vez. Multiplique cada coeficiente (escrito en subíndice después del símbolo del átomo en el compuesto) por el número de oxidación.
En cuanto a na2ENTONCES4, sabemos que hay 2 atomos de Na y 4 atomos de O. Ahora realizamos el siguiente cálculo, 2 × +1, para obtener el número de oxidación de Na, 2, y multiplicamos 4 × -2, el número de oxidación de O, -8.4. Sume los resultados juntos. Sumando los resultados de estas multiplicaciones da el número de oxidación del compuesto,sin que para tener en cuenta el número de oxidación del átomo desconocido.
En nuestro ejemplo con Na2ENTONCES4, sumamos 2 a -8 para obtener -6.5. Calcular el número de oxidación desconocido basado en la carga del compuesto. Ahora tiene todos los datos para encontrar el número de oxidación desconocido usando algo de álgebra simple. Usamos una ecuación y la respuesta del paso anterior, más la carga del compuesto. En otras palabras: (Suma de los números de oxidación desconocidos) + (el número de oxidación desconocido que desea saber) = (carga del compuesto).
En el ejemplo de Na2ENTONCES4, esto lo resolvemos de la siguiente manera:(Suma de números de oxidación conocidos) + (número de oxidación desconocido que desea resolver) = (carga del compuesto)-6 + S = 0S = 0 + 6S = 6. S tiene un número de oxidación o 6 en nac2ENTONCES4.Consejos
- Los átomos en su forma básica siempre tienen número de oxidación 0. Un ion que consta de 1 átomo tiene un número de oxidación igual a la carga. Los metales del grupo 1A como el hidrógeno, el litio y el sodio tienen un número de oxidación de +1; Los metales del grupo 2A, como el magnesio y el calcio, tienen un número de oxidación de +2. Tanto el hidrógeno como el oxígeno pueden tener 2 números de oxidación diferentes dependiendo de su enlace.
- En un compuesto, la suma de todos los números de oxidación debe ser igual a 0. Si hay un ion con 2 átomos, entonces la suma de los números de oxidación debe ser igual a la carga del ion.
- Es muy útil saber cómo leer la tabla periódica, y dónde encontrar los metales y no metales.
Artículos de primera necesidad
- Tabla Periódica de los Elementos
- una conexión a internet
- un libro de quimica
- Papel, pluma o lápiz
- Calculadora
Artículos sobre el tema. "Cálculo del número de oxidación de una sustancia"