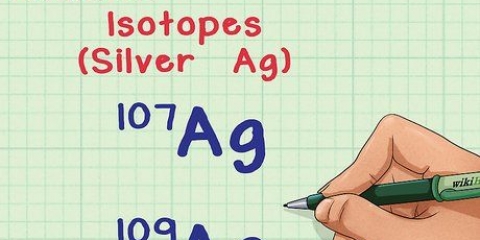norte = METRO – norte N = número norteeutrones M = átomo metroculo n = átomo nortenúmero 




norte = METRO – norte N = número norteeutrones M = átomo metroculo n = átomo nortenúmero
Determinar el número de neutrones en un átomo
Contenido
Determinar el número de neutrones en un átomo es muy fácil y ni siquiera necesitas hacer un experimento para ello. Para calcular el número de neutrones en un átomo o isótopo todo lo que necesitas hacer es seguir estas instrucciones.
Pasos
Método 1 de 2: encontrar el número de neutrones en un átomo

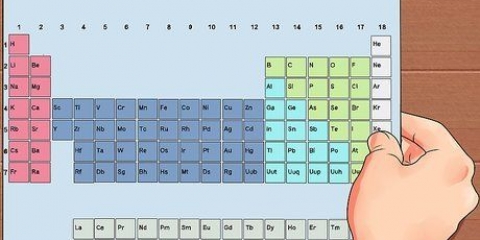
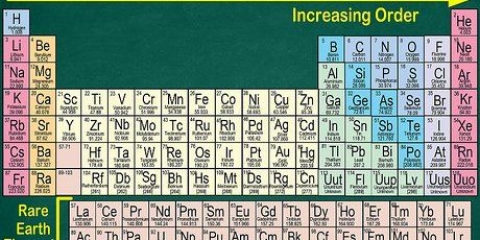
1. Busca el elemento en la tabla periódica. En este ejemplo estamos viendo Osmio (Os), en la fila 6.

2. Encuentre el número atómico del elemento. Este suele ser el número sobre el símbolo del elemento. (En la tabla que usamos este es el único número.) El número atómico es el número de protones en un átomo de ese elemento. Os tiene el número 76, lo que significa que un átomo de Osmio tiene 76 protones.

3. Encuentre la masa atómica del elemento. Este suele ser el número debajo del símbolo del elemento. (Esto no se menciona en la tabla que usamos).El osmio tiene una masa atómica de 190,23.

4. Redondea la masa atómica al número entero más cercano para encontrar la masa atómica. En nuestro ejemplo, 190,23 se redondea a 190, lo que da como resultado una masa atómica de 190 para el osmio.

5. Reste el número atómico de la masa atómica. Dado que la mayor parte del peso de un átomo lo ocupan los protones y los neutrones, restando el número de protones (p. el número atómico) de la masa atómica producen el número de neutrones en el átomo Los números después del punto decimal representan la masa muy pequeña de los electrones en el átomo. En nuestro ejemplo esto es: 190 (masa atómica) – 76 (número de protones) = 114 (número de neutrones).

6. Recuerda la fórmula. Para encontrar el número de neutrones en el futuro, use la siguiente fórmula:
Método 2 de 2: encontrar el número de neutrones en un isótopo

1. Busca el elemento en la tabla periódica. Como ejemplo nos fijamos en el isótopo Carbon-14. Dado que el Carbono-14 es un isótopo del Carbono(C), intente encontrar el carbono en la tabla periódica (en la segunda fila).

2. Encuentre el número atómico del elemento. Este suele ser el número sobre el símbolo del elemento. (En la tabla que usamos este es el único número.) El número atómico es el número de protones en un átomo de ese elemento. C es el número 6, lo que significa que un átomo de carbono tiene 6 protones.

3. Encuentra la masa atómica. Con los isótopos esto es muy fácil, porque su nombre se toma de su masa atómica. El carbono-14, por ejemplo, tiene una masa atómica de 14. Ahora que conoce la masa atómica, todo el proceso es como encontrar el número de neutrones en un átomo ordinario.

4. Reste el número atómico de la masa atómica. Dado que la mayor parte del peso de un átomo está ocupado por protones y neutrones, restando el número de protones (i.mi. el número atómico) de la masa atómica producen el número de neutrones en el átomo. En nuestro ejemplo esto es: 14 (masa atómica) – 6 (número de protones) = 8 (número de neutrones).

5. Recuerda la fórmula. Para encontrar el número de neutrones en el futuro, solo usa la siguiente fórmula:
Consejos
- El osmio, un metal que es sólido a temperatura ambiente, toma su nombre de la palabra griega para olor, "osme.”
- Si alguna vez no está seguro de qué representa un número en particular en la tabla periódica, recuerde que la tabla generalmente se construye alrededor del número atómico (número de protones), comenzando en 1 para el hidrógeno y subiendo hasta 118 (Ununoctium). Esto se debe a que el número de protones en un átomo determina el átomo, lo que lo convierte en la propiedad preferida de un elemento para una división clara. (p.ej. un átomo con 2 protones siempre es helio, al igual que un átomo con 79 protones siempre es oro.)
Artículos sobre el tema. "Determinar el número de neutrones en un átomo"
Оцените, пожалуйста статью
Similar
Popular