Si es un decimal, probablemente estés viendo la masa atómica. 
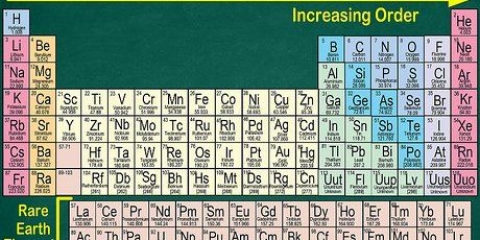
Puede haber un espacio vacío después de los elementos 56 (bario) y 88 (radio). En realidad no hay un espacio; los elementos con los números atómicos que le corresponden están en dos filas debajo del resto del sistema. La única razón por la que se separan así es para que la tabla periódica sea menos ancha. 
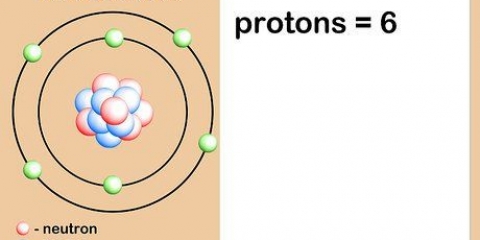
Dicho de otro modo, cualquier átomo con ocho protones es un átomo de oxígeno. Dos átomos de oxígeno pueden tener un número diferente de neutrones o (si uno es un ion) un número diferente de electrones, pero ambos siempre tendrán ocho protones. 

En la práctica, la masa atómica generalmente ya se da para los problemas de química que tratan con un solo átomo. Comprender este concepto para no sorprenderse si difiere del peso atómico. 
Esto funciona porque los neutrones y los protones están cerca de 1 AMU y los electrones están cerca de 0 AMU. Para el peso atómico se utilizan medidas precisas para obtener el número decimal, pero sólo nos interesan los números enteros que nos dicen el número de protones y neutrones. Recuerda que si usas el peso atómico obtienes un promedio para una muestra típica. Una muestra de bromo tiene un número de masa de aproximadamente 80, pero resulta que un solo átomo de bromo casi siempre tiene un número de masa de 79 u 81. 
Un solo átomo de helio (He) tiene un número de masa de 4 y un número atómico de 2. Por lo tanto debe ser 4 - 2 = 2 neutrones tener. Una muestra de plata (Ag) tiene un número de masa de alrededor de 108 (según la tabla periódica) y un número atómico de 47. En promedio, cada átomo de plata en la muestra tiene 108 - 47 = 61 neutrones. 
Los isótopos no tienen un número atómico diferente. Cada isótopo de un elemento tiene el mismo número de protones.
Determinar el número atómico de un elemento
Contenido
El número atómico de un elemento es el número de protones en el núcleo de un solo átomo de ese elemento. El número atómico de un elemento o isótopo no cambia, por lo que puede utilizar el número atómico para calcular otras características de un elemento o isótopo, como el número de neutrones.
Pasos
Parte 1 de 2: encontrar el número atómico

1. Encuentra una copia de la tabla periódica. Puedes encontrar uno aquí si no tienes uno a mano. Cada elemento tiene un número atómico diferente, por lo que no existen métodos rápidos y fáciles de aplicar. Tendrás que encontrar una copia de la tabla periódica o una hay que aprender de memoria.
- La mayoría de los libros de química tienen una tabla periódica impresa en el interior de la cubierta.

2. Encuentra el elemento que estás estudiando. La mayoría de las tablas periódicas contienen los nombres completos de los diversos elementos, así como sus símbolos químicos (como Hg para mercurio). Si tiene problemas para encontrar el elemento, debe buscar en línea "símbolo químico" seguido del nombre del elemento.

3. Encuentra el número atómico. El número atómico generalmente se encuentra en la esquina superior izquierda o derecha del cuadro en el que se encuentra el elemento, pero también puede estar en otro lugar del cuadro. El número atómico es siempre un número entero.

4. Verificar contra elementos vecinos. La tabla periódica está ordenada por número atómico. Si el número atómico de su elemento es `33`, entonces el elemento de la izquierda debe ser `32` y el elemento de la derecha debe ser `34`. Si este orden es correcto definitivamente has encontrado el número atómico.

5. Entender lo que es el número atómico. Hay una definición simple para el número atómico de un elemento: el número de protones en un átomo de ese elemento. Esta es la definición básica de un elemento. El número de protones determina la carga eléctrica total del núcleo, lo que determina cuántos electrones puede tener un átomo. Dado que los electrones son responsables de casi todas las reacciones químicas, el número atómico determina indirectamente casi todas las propiedades físicas y químicas de un elemento.
Parte 2 de 2: encontrar información relacionada

1. Encontrar el peso atómico. El peso atómico suele estar impreso bajo el nombre del elemento en cuestión en la tabla periódica y suele calcularse con dos o tres decimales. Esta es la masa promedio de un átomo del elemento, ajustada para que coincida con lo que probablemente encuentre en la naturaleza. Este número está en "unidades de masa atómica" (AMU (del inglés "atomic mass unit")).
- Algunos científicos usan el término "masa atómica relativa" en lugar de "peso atómico".

2. Entender lo que es la masa atómica. La masa atómica es un concepto muy similar al de peso atómico. La única diferencia es que estás hablando de un átomo específico en lugar del promedio de una muestra. Un gramo de hierro contiene muchos átomos con masas que difieren ligeramente entre sí, por lo que busca el `peso relativo` para encontrar el promedio. Si solo está interesado en un átomo de hierro específico, el promedio no le importa, solo está interesado en la masa exacta de ese átomo en particular.

3. Redondear al número de masa. El número de masa es el número total de protones más neutrones en un átomo de un elemento. Puede encontrar este número fácilmente: simplemente tome el peso atómico dado en la tabla periódica y redondee al número entero más cercano.

4. Calcular el número de neutrones. Ahora sabes que el número atómico = número de protones, y que el número de masa = número de protones + número de neutrones. Para saber cuantos neutrones hay en un elemento hay que restarle el numero atomico al numero masico. Aquí están algunos ejemplos:

5. Entender qué son los isótopos. Un isótopo es una forma específica de un elemento con un cierto número de neutrones. Cuando una pregunta de química habla de "boro-10" o "B", están hablando del elemento boro con un número de masa de 10. Use este número de masa en lugar del valor del boro `típico`.
Consejos
- Algunos elementos más pesados tienen pesos atómicos entre paréntesis o paréntesis. Esto significa que el peso atómico es la masa exacta del isótopo más estable, en lugar del promedio de varios isótopos. (Esto no tiene ningún efecto sobre el número atómico del elemento.)
Artículos sobre el tema. "Determinar el número atómico de un elemento"
Оцените, пожалуйста статью
Similar
Popular