Cada nivel de energía puede contener hasta 2 electrones. Cada nivel de energía p puede contener hasta 6 electrones. Cada nivel de energía d puede contener hasta 10 electrones. Cada nivel de energía f puede contener hasta 14 electrones. 
El nivel de energía d tiene una energía ligeramente más alta que el nivel de energía s de la capa de electrones inferior, por lo que es más probable que se llene el nivel de energía s más alto que el nivel de energía d más bajo. Para escribir una configuración electrónica, esto significa que se verá así: 1s2s2p3s3p4s3d. 
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p Por ejemplo: La configuración electrónica del sodio (11 electrones) es: 1s2s2p3s. 
Por ejemplo, el sodio está en el bloque s, por lo que el último orbital de su configuración electrónica es s. Está en la tercera fila y primera columna, por lo que el último orbital es 3s. Esta es una buena manera de verificar su respuesta final. La regla es un poco diferente para el orbital d. La primera fila de elementos del bloque d comienza en la cuarta fila, pero debe restar 1 del número de fila porque los niveles s tienen una energía más baja que los niveles d. Por ejemplo: el vanadio termina en 3d. Otra forma de verificar su trabajo es sumar todos los superíndices. Deben ser iguales al número de electrones en el elemento. Si tienes muy pocos o demasiados electrones, debes repensar tu trabajo e intentarlo de nuevo. 

1: helio 2: Neón 3: Argón 4: criptón 5: xenón 6: Radón Por ejemplo, el sodio está en el período 3. Usaremos neón para la configuración de gas noble porque está en el período 2. 
Por ejemplo, el sodio tiene 11 electrones y el neón tiene 10 electrones. La configuración electrónica completa para el sodio es: 1s22p3s y el neón es 1s22p. Como puede ver, el sodio tiene un 3s que el neón no tiene; es por eso que la configuración de gas noble para el sodio se convierte en [Ne]3s. Alternativamente, puede contar los superíndices de los niveles de energía hasta que tenga diez. Eliminar estos niveles de energía y dejar solo lo que queda. Si usa neón para escribir la configuración electrónica del sodio, le queda un electrón: [Ne]3s.
Escritura de la configuración de gas noble de un elemento
Contenido
Escribir una configuración electrónica para un elemento es una buena manera de ver la distribución de electrones en un átomo. Dependiendo del elemento, la fórmula puede ser muy larga. Por lo tanto, los científicos han desarrollado una notación abreviada que usa un gas noble para representar electrones que no son electrones de valencia. Esto simplifica la configuración electrónica y facilita la comprensión de las propiedades químicas del elemento.
Pasos
Parte 1 de 2: la configuración electrónica normal de un elemento

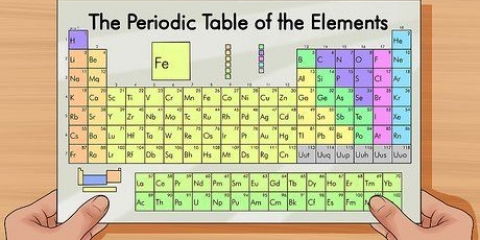
1. Determinar el número de electrones presentes en el elemento. El número atómico de un elemento te dice cuántos protones tiene. Dado que los elementos en su estado neutro tienen la misma cantidad de protones y electrones, también puede usar el número atómico como la cantidad de electrones que tiene el elemento. El número atómico, que puedes encontrar en el tabla periódica, es el número inmediatamente encima del símbolo del elemento.
- Por ejemplo: el símbolo del sodio es Na. El número atómico del Na es 11.

2. Conocimiento sobre capas de electrones y niveles de energía. La primera capa de electrones tiene solo el nivel de energía s, la segunda capa de electrones tiene un nivel de energía s y p. La tercera capa de electrones tiene un nivel de energía s, p y d. La cuarta capa de electrones tiene un nivel de energía s, p, d y f. Hay más de cuatro capas de electrones, pero en la química de la escuela secundaria generalmente solo encontrarás los primeros cuatro.

3. Aprende las reglas del llenado de electrones. De acuerdo con el principio de Aufbau, debe agregar electrones a los niveles de energía más bajos antes de que un electrón pueda agregarse a un nivel de energía más alto. Cada nivel de energía puede tener múltiples suborbitales, pero cada suborbital puede contener hasta dos electrones en un momento dado. El nivel de energía s tiene un suborbital, p tiene 3 suborbitales, d tiene 5 suborbitales y f tiene 7 suborbitales.

4. Use el gráfico de configuración diagonal para escribir configuraciones electrónicas. La forma más fácil de recordar cómo se llenan los electrones es usar el diagrama de configuración. En este anotas cada caparazón y sus niveles de energía. Dibuja líneas diagonales desde la parte superior derecha hasta la parte inferior izquierda de cada línea. El esquema de configuración se ve así:
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p

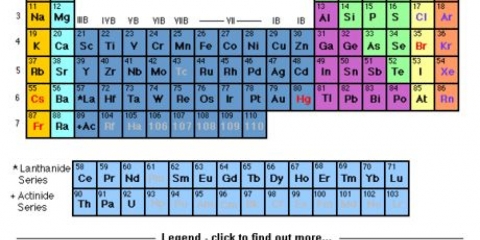
5. Determinar el último orbital de cualquier configuración. Al observar la tabla periódica, puede determinar cuál será la última subcapa y el último nivel de energía de la configuración electrónica. Primero determine en qué bloque cae el elemento (s, p, d o f). Luego cuente en qué fila se encuentra el elemento. Finalmente, cuente en qué columna se encuentra el elemento.
Parte 2 de 2: la configuración electrónica del gas noble

1. Determinar la configuración electrónica del gas noble. La configuración electrónica de los gases nobles es una especie de forma abreviada de escribir la configuración electrónica completa de un elemento. La abreviatura de gas noble se utiliza para resumir la configuración electrónica de un elemento y, al mismo tiempo, proporciona la información más relevante sobre los electrones de valencia de ese elemento.
- El gas noble se sustituye para representar todos los electrones que no son electrones de valencia.
- Los gases nobles son helio, neón, argón, criptón, xenón y radón y se enumeran en la última columna de la tabla periódica.

2. Identifique el gas noble en el período para su elemento. El periodo de un elemento es la fila horizontal en la que se encuentra el elemento. Si el elemento está en la cuarta fila de la tabla periódica, está en el período cuatro. El gas noble que usará está en el período tres. A continuación se muestra una lista de los gases nobles y sus períodos:

3. Reemplace el gas noble con la misma cantidad de electrones que tiene el gas noble. Hay algunas maneras de hacer este siguiente paso. Puede escribir la configuración electrónica del gas noble y luego reemplazar esa misma configuración en el elemento de su interés. Una alternativa es eliminar la misma cantidad de electrones que tiene el gas noble del elemento para el que está escribiendo la configuración.
Advertencias
- Solo en un átomo neutro el número atómico es igual al número de electrones. Un ion contiene un número diferente de electrones. Si el ion tiene una carga de -1, entonces tiene un electrón extra. Una carga -2 tiene dos electrones extra, etc.
Artículos sobre el tema. "Escritura de la configuración de gas noble de un elemento"
Оцените, пожалуйста статью
Popular