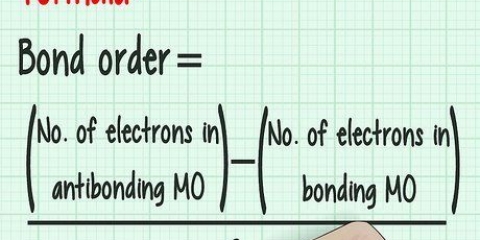
Por ejemplo: un átomo de sodio con una carga de -1 tiene un electrón extra añadido a el número atómico de 11. Así que este átomo de sodio tiene 12 electrones en total. El orbital s (cualquier número en la configuración electrónica seguido de un "s") contiene un solo orbital, y debido a la Principio de exclusión de Pauli sabemos que un solo orbital puede contener un máximo de 2 electrones, por lo que cualquier forma de orbital puede contener 2 electrones. El orbital p contiene 3 orbitales, por lo que puede contener un total de 6 electrones. el orbital d contiene 5 orbitales, por lo que puede contener 10 electrones. el orbital f contiene 7 orbitales, por lo que puede contener 14 electrones. Por ejemplo, una configuración electrónica simple: 1s 2s 2p. Esta configuración indica que hay dos electrones en la forma orbital 1s, dos electrones en la forma orbital 2s y seis electrones en la forma orbital 2p. 2 + 2 + 6 = 10 electrones en total. Esta es la configuración electrónica de un átomo de neón sin carga (Ne; número atómico 10.) La configuración electrónica de un átomo en el que cada orbital está completamente lleno se escribe de la siguiente manera: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p Tenga en cuenta que en la lista anterior, si todas las capas están llenas, esta es la configuración electrónica de ununoctio (Uuo; número atómico 118), el número más alto en la tabla periódica, por lo que esta configuración electrónica contiene cada capa de electrones conocida ahora en un átomo sin carga. Llene los orbitales con electrones en el orden anterior hasta llegar a veinte. El orbital 1s obtiene dos electrones, el 2s obtiene dos, el 2p obtiene seis, el 3s obtiene dos, el 3p obtiene 6 y el 4s obtiene 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Entonces, la configuración electrónica para el calcio es: 1s 2s 2p 3s 3p 4s. Nota: los niveles de energía cambian a medida que subes de nivel. Por ejemplo, si está a punto de pasar al 4º nivel de energía, serán 4 s, después 3d. Después del cuarto nivel, continúa con el quinto nivel, donde se reanuda el orden normal. Esto solo sucede después del tercer nivel de energía. Las dos columnas del extremo izquierdo son una representación de átomos cuyas configuraciones electrónicas terminan en orbitales s, el bloque derecho de esta tabla es una representación de átomos cuyas configuraciones terminan en orbitales p, la parte central, los átomos que terminan en un orbital d, y la región inferior, átomos que terminan en orbitales f. Por ejemplo, al escribir una configuración electrónica para el cloro (Cl), considere: "Este átomo está en la tercera fila (o "período de tiempo") de la tabla periódica. También está en la quinta columna del grupo de orbitales p. Entonces esta configuración electrónica termina en ...3p Nota: los grupos de orbitales d y f en la tabla corresponden a niveles de energía diferentes del período en el que se encuentran. Por ejemplo, la primera fila de los orbitales del grupo d corresponde al orbital 3d aunque esté en el período 4, mientras que la primera fila de los orbitales f corresponde al orbital 4f aunque esté en el sexto período. Para entender bien este concepto, es útil anotar un ejemplo de configuración. Escribamos la configuración del zinc (número atómico 30) usando la notación abreviada para un gas noble. La configuración electrónica completa del zinc es: 1s 2s 2p 3s 3p 4s 3d. Pero observe que 1s 2s 2p 3s 3p es la configuración del gas noble argón. Simplemente reemplace esta parte de la notación de zinc con el símbolo químico del argón entre corchetes ([Ar].) Entonces, la notación abreviada de la configuración electrónica del zinc se puede escribir como [Ar]4s 3d. 
Vaya a los números del 1 al 8 en la parte inferior (la base) de la tabla. Estos son los números de las capas de electrones, o las columnas. Ignora las columnas tachadas. Las columnas que quedan para el erbio son 1,2,3,4,5 y 6. Nota: La configuración electrónica anterior de Er (erbio) se enumera en orden ascendente de números de capa. También se puede escribir en el orden de los orbitales. Simplemente siga las cascadas de arriba a abajo, en lugar de las columnas, si está escribiendo los grupos de columnas: 1s 2s 2p 3s 3p 4s 3d 4p 5s4d 5p 6s 4f. cr(..., 3d5, 4s1); cobre(..., 3d10, 4s1); Nótese bien(..., 4d4, 5s1); mes(..., 4d5, 5s1); tu(..., 4d7, 5s1); Rh(..., 4d8, 5s1); p.d(..., 4d10, 5s0); agricultura(..., 4d10, 5s1); La(..., 5d1, 6s2); Ce(..., 4f1, 5d1, 6s2); Di-s(..., 4f7, 5d1, 6s2); es(..., 5d10, 6s1); C.A(..., 6d1, 7s2); sin embargo(..., 6d2, 7s2); Pensilvania(..., 5f2, 6d1, 7s2); UDS(..., 5f3, 6d1, 7s2); notario público(..., 5f4, 6d1, 7s2) y cm(..., 5f7, 6d1, 7s2).
Escribiendo configuraciones electrónicas para elementos
Contenido
El configuración electronica de un átomo es una representación numérica de los orbitales electrónicos. Los orbitales de electrones son regiones de diferentes formas alrededor del núcleo de un átomo, donde se puede demostrar matemáticamente que existe la posibilidad de que haya electrones allí. Es fácil y rápido leer a partir de una configuración electrónica cuántos orbitales electrónicos tiene un átomo y cuántos electrones están presentes en cada orbital. Aquí aprenderás cómo empezar a crear tu propia configuración electrónica.
Pasos
Método 1 de 2: Método uno: asignar electrones usando la tabla periódica

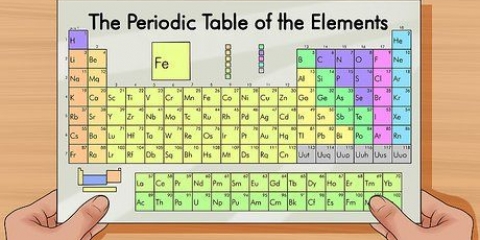
1. Encuentra el número atómico. Cada átomo tiene asociado un número específico de electrones. Encuentra el símbolo químico de tu átomo en la tabla periódica. El número atómico es un número entero positivo que comienza en 1 (para el hidrógeno) y aumenta en 1 para cada átomo subsiguiente. El número atómico es el número de protones en ese átomo, por lo que también es el número de electrones en ese átomo si no tiene carga.
2. Determinar la carga del átomo. Los átomos sin carga tienen exactamente el mismo número de protones que de electrones, como se indica en la tabla periódica. Pero este no es el caso de los átomos cargados. Si se trata de un átomo cargado, sume o reste los electrones de la siguiente manera: sume un electrón por cada carga negativa y reste uno por cada carga positiva.
3. Memoriza la lista básica de orbitales. Cuando un átomo gana electrones, llenan diferentes conjuntos de orbitales en un orden fijo. Cada orbital, cuando está lleno, contiene un número fijo de electrones. Las formas de los orbitales son:
4. Comprender la notación de una configuración electrónica. Las configuraciones electrónicas se anotan de tal manera que es claro cuántos electrones están presentes en el átomo y cuántos electrones hay en cada orbital. Un orbital tiene una notación fija con el número de electrones en superíndice después del nombre del orbital. La configuración electrónica final es una serie de formas orbitales y superíndices.
5. Aprende el orden de los orbitales.Tenga en cuenta que las formas orbitales están numeradas por la capa de electrones, pero ordenadas por nivel de energía. Por ejemplo, un 4s completamente lleno tiene menos energía (o menos potencial) que un 3d parcialmente lleno o lleno, por lo que el caparazón 4s está al frente. Si conoces el orden de los orbitales, no es difícil llenarlos según el número de electrones en el átomo. El orden en que se llenan los orbitales es el siguiente: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
6. Llena los orbitales de acuerdo a la cantidad de electrones en tu átomo. Por ejemplo, si quisiéramos escribir la configuración electrónica de un átomo de calcio sin carga, comenzaríamos buscando el número atómico en la tabla periódica. El número atómico del calcio es 20, por lo que escribimos una configuración para este átomo con 20 electrones en el orden que se muestra arriba.
7. Usa la tabla periódica como ayuda visual. Es posible que haya notado que el orden de la tabla periódica corresponde al orden de las formas orbitales en las configuraciones electrónicas. Por ejemplo, los átomos en la segunda columna de la izquierda siempre terminan con "s", los átomos en el extremo derecho en la sección central angosta siempre terminan en "D," etc. Use la tabla periódica como una guía visual para observar las configuraciones: el orden en que agrega electrones a los orbitales corresponde a la posición en la tabla de la tabla periódica. Fíjate bien en lo siguiente:
8. Aprenda la abreviatura para escribir configuraciones electrónicas largas. Los átomos del lado derecho de la tabla periódica se llaman Gases nobles. Estos elementos son muy estables. Para acortar el proceso de anotar una configuración electrónica larga, escriba el símbolo químico del gas más cercano, con menos electrones que su átomo, entre corchetes, luego continúe con la configuración electrónica para las siguientes formas orbitales. Vea abajo:
Método 2 de 2: Método dos: hacer uso de una tabla periódica ADOMAH

1. Entendiendo la Tabla Periódica de ADOMAH. Con este método de observar configuraciones electrónicas, no es necesario memorizar mucho. Pero sí requiere una tabla periódica ordenada de manera diferente, porque dentro de la tabla periódica tradicional, las capas de electrones, a partir de la cuarta fila, no corresponden a los números periódicos. Intente encontrar un ejemplo de este sistema diseñado por Valery Tsimmerman en línea. Seguramente esto no es un problema.
- Dentro de la Tabla Periódica ADOMAH, las filas representan grupos de elementos, como halógenos, gases inertes, metales alcalinos, etc.Las columnas corresponden a las capas de electrones y las "cascadas" (líneas diagonales que conectan los grupos s, p, d y f) corresponden a los períodos.
- El helio ahora está al lado del hidrógeno porque ambos se caracterizan por el orbital 1s. Los períodos (s, p, d y f) están a la derecha y los números de capa en la parte inferior de la tabla. Los elementos se enumeran en casillas numeradas del 1 al 120. Estos números representan los números atómicos ordinarios e indican el número de electrones en un átomo neutro.
2. Busca tu átomo en la tabla ADOMAH. Para poder escribir la configuración electrónica de un elemento, busca su símbolo en la Tabla Periódica de ADOMAH y tacha todos los elementos con números atómicos más altos. Por ejemplo, si desea conocer la configuración electrónica del erbio (68), cruce los elementos del 69 al 120.
3. Cuenta los orbitales hasta tu átomo. Al observar el grupo de símbolos en el lado derecho de la tabla (s, p, d y f) y los números de columna en la parte inferior de la tabla e ignorar las líneas diagonales entre ellos, puede dividir las columnas en grupos y lista de abajo hacia arriba. Nuevamente, ignore esos bloques con todos los elementos tachados. Escriba los grupos de columnas, comenzando con el número de columna seguido del símbolo del grupo, así: 1s2s2p3s3p3d4s4p4d4f5s5p6s (en el caso de erbium).
4. Contar los electrones de cada forma orbital. Cuente los elementos que no están tachados en cada grupo de columnas, eligiendo un electrón por elemento, y escriba el número junto a los símbolos de grupo de cada grupo de columnas, así: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. Esta es la configuración electrónica de Er (erbio) de nuestro ejemplo.
5. Conocer las configuraciones electrónicas irregulares. Hay dieciocho excepciones a las configuraciones electrónicas en los átomos del nivel de energía más bajo, también conocido como estado fundamental. Estos se desvían de la regla general para las últimas dos o tres posiciones de electrones. En estos casos, las configuraciones electrónicas reales mantienen a los electrones en un nivel de energía más bajo que en una configuración estándar de ese átomo. Los átomos irregulares son:
Consejos
- Para encontrar el número atómico de un átomo cuando está escrito en forma de configuración electrónica, se suman todos los números que vienen después de las letras (s, p, d y f). Esto solo funciona en un átomo neutro, no en un ion, y hay que restar o sumar todos los electrones que se pierden o se suman.
- El número después de la letra está en superíndice, así que no se equivoque con una prueba.
- No existe tal cosa como el "estabilidad de un medio lleno" subnivel. esto es demasiado simple. La estabilidad se debe a que cada orbital está ocupado por un solo electrón, por lo que la repulsión electrón-electrón es mínima.
- Cada átomo quiere volver a un estado estable, y las configuraciones más estables tienen orbitales s y p (s2 y p6) completamente llenos. Los gases nobles tienen esta configuración, por eso casi nunca son reactivos y se ubican en el lado derecho de la tabla periódica. Entonces, si una configuración termina en 3p, solo necesita dos electrones más para estabilizarse (perder seis electrones, incluido el del orbital s, requiere más energía, por lo que es más fácil perder cuatro). Y si una configuración termina en 4d, solo necesita perder tres electrones más para llegar a un estado estable. También sostiene que las conchas a medio llenar (s1, p3, d5..) son más estables que, por ejemplo, p4 o p2; s2 y p6 serán aún más estables.
- Cuando el átomo es un ion, significa que el número de protones no es igual al número de electrones. La carga del átomo generalmente se indica en la esquina superior derecha del símbolo. Entonces, un átomo de antimonio con una carga +2 tiene una configuración electrónica de 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Tenga en cuenta que el 5p se ha cambiado a 5p. Tenga en cuenta esto si la configuración de un átomo sin carga termina en algo que no sea un orbital s y p. Si elimina electrones, solo puede hacerlo en los orbitales de valencia (los orbitales s y p). Entonces, si una configuración termina en 4s 3d y la carga del átomo aumenta en +2, entonces la configuración cambia para que termine en 4s 3d. Recuerda que 3dno cambia, pero que el orbital s pierde sus electrones.
- Hay circunstancias en las que un electrón gana un nivel más alto. Cuando un orbital está a solo un electrón de estar lleno a la mitad o por completo, retire un electrón del orbital s o p más cercano y muévalo al orbital que necesita ese electrón.
- También puede escribir la configuración electrónica de un elemento simplemente escribiendo su configuración de valencia, el último orbital s y p. Entonces, la configuración de valencia del antimonio se convierte en 5s 5p.
- Los iones no son lo mismo, pero mucho más difíciles. Salta dos niveles y luego sigue el mismo patrón dependiendo de dónde empezaste y la cantidad de electrones.
Artículos sobre el tema. "Escribiendo configuraciones electrónicas para elementos"
Оцените, пожалуйста статью
Popular