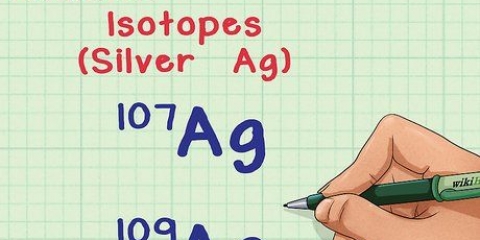Use el término `leer un grupo` para leer de arriba a abajo. La numeración suele indicarse encima de las columnas; sin embargo, también puede pertenecer a otros grupos, como los metales. La numeración utilizada en la tabla periódica difiere mucho. Pueden ser romanos (IA), árabes (1A) o los números del 1 al 18. El hidrógeno puede estar en la familia de los halógenos y los metales alcalinos, o ambos. 
Los períodos generalmente se numeran del 1 al 7 en el lado izquierdo de la tabla. Cada periodo es mayor que el anterior. Esto está relacionado con el aumento de los niveles de energía de los átomos en la tabla periódica. 
Los metales del grupo tienen un color. Sin embargo, el hidrógeno a menudo tiene el mismo color y grupo que los no metales. Los metales tienen brillo, suelen ser sólidos a temperatura ambiente, conducen el calor y la electricidad, y son maleables y maleables. Los no metales tienen el mismo color. Estos son los elementos C-6 a Rn-86, incluido H-1 (hidrógeno). No tienen brillo, conducen el calor y la electricidad y no son maleables. Suelen formar un gas a temperatura ambiente y pueden ser sólidos, gaseosos o líquidos. Los semimetales/metaloides suelen tener un color púrpura o verde, como combinación de los otros dos colores. La línea es diagonal, extendiéndose desde los elementos B-5 hasta At-85. Tienen algunas propiedades de los metales y algunas de los no metales. 
La numeración puede ser números romanos, arábigos o estándar. 





Tenga en cuenta que hay una excepción a esta regla. Si el átomo pierde o gana electrones, se convierte en un ion cargado eléctricamente. Si hay un signo más al lado del símbolo del elemento, indica que tiene carga positiva. Con un símbolo menos, está cargado negativamente. Si no tiene un símbolo de más o menos, y su problema de química no se trata de iones, entonces la cantidad de protones y electrones probablemente sea igual. 


Por ejemplo: la masa atómica del hierro es 55,847, por lo que el número de masa es 56. El elemento tiene 26 protones. 56 (número de masa) menos 26 (protones) es 30. Por lo general, hay 30 neutrones en un solo átomo de hierro. Cambiar el número de neutrones en un átomo forma isótopos, que son versiones más pesadas o más ligeras del átomo.
Entendiendo la tabla periódica de los elementos
Contenido
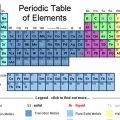
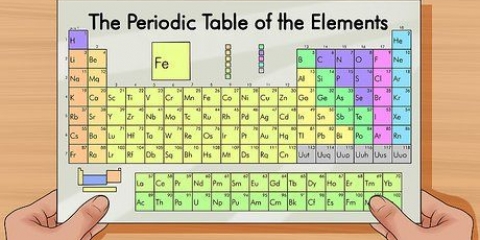
La tabla periódica de elementos es una lista de los 118 elementos descubiertos hasta el momento. Hay varios símbolos y números que indican las diferencias en los elementos, mientras que la estructura de la tabla organiza los elementos según similitudes. Puede leer la tabla periódica siguiendo las pautas a continuación.
Pasos
Parte 1 de 4: comprender la estructura

1. Piense en la tabla periódica como si comenzara en la parte superior izquierda y terminara al final de la última fila, abajo y a la derecha. La tabla está estructurada de izquierda a derecha en orden creciente de número atómico. El número atómico es el número de protones en un solo átomo.
- No todas las filas o columnas están completas. Aunque puede haber espacios en el medio, siga leyendo la tabla de izquierda a derecha. Por ejemplo, el hidrógeno tiene el número atómico 1 y está en la esquina superior izquierda. El helio tiene el número atómico 2 y se encuentra en la esquina superior derecha.
- Los elementos del 57 al 71 generalmente se representan como un subconjunto en la esquina inferior derecha de la tabla. Estos son los `elementos de tierras raras`.

2. En cada columna de la tabla encontrarás un `grupo` de elementos. hay 18 columnas.

3. En cada fila de la tabla encontrarás los `períodos` de los elementos. hay 7 periodos. Use la expresión `leer a lo largo de un punto` para leer de izquierda a derecha.

4. Comprender los grupos adicionales a metal, semimetal y no metal. Los colores varían mucho.

5. Sepa que los elementos a veces también se indican en familias. Estos son los metales alcalinos (1A), metales alcalinotérreos (2A), halógenos (7A), gases nobles (8A) y átomos de carbono (4A).
Parte 2 de 4: comprensión del símbolo y denominación

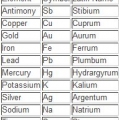
1. Lea primero el símbolo. Consta de una o dos letras y es estándar en varios idiomas.
- El símbolo puede derivarse del nombre latino del elemento o del nombre común común.
- En muchos casos, el símbolo sigue la convención de nomenclatura en inglés, como Helium, también conocido como `He`. Sin embargo, no es una regla que puedas asumir. Por ejemplo, el hierro es `Fe`. Por esta razón, la combinación de símbolo/nombre suele recordarse como referencia rápida.

2. Mira el nombre común. Esto está directamente debajo del símbolo. Difiere según el idioma en el que esté escrita la tabla periódica.
Parte 3 de 4: Lectura del número atómico

1. Leer la tabla periódica según el número atómico en la parte superior central del recuadro de cada elemento. Como se mencionó anteriormente, el sistema está ordenado de arriba a la izquierda a abajo a la derecha. Conocer el número atómico es la forma más rápida de buscar más información sobre el elemento.

2. El número atómico es el número de protones en el núcleo de un solo átomo del elemento.

3. Agregar o quitar protones crea otro elemento.

4. Averiguar el número de protones en un átomo es también determinar el número de electrones. Los átomos tienen el mismo número de electrones que de protones.
Parte 4 de 4: lectura de la masa atómica

1. Determinar la masa atómica. Este es el número bajo el nombre común del elemento.
- Si bien puede parecer que la masa atómica aumenta desde la parte superior izquierda del sistema hasta la parte inferior derecha, esto no es cierto en todos los casos.

2. Comprender que la mayoría de los elementos se muestran con decimales. La masa atómica es el total de las partículas en el núcleo; sin embargo, es un promedio ponderado de los diferentes isótopos.

3. Usa la masa atómica para encontrar el número de neutrones en un solo átomo. Redondea la masa atómica al número entero más cercano, el número de masa. Luego restas el número de protones del número de masa para encontrar el número de neutrones.
Artículos sobre el tema. "Entendiendo la tabla periódica de los elementos"
Оцените, пожалуйста статью
Similar
Popular