K Shell (interior): 2 electrones máximo. L Shell: 8 electrones máximo. M Shell: 18 electrones máximo. N Shell: 32 electrones máximo. O Shell: 50 electrones máximo. P Shell (exterior): 72 electrones máximo. 
Si la capa de valencia está llena, entonces el elemento es estable. Si la capa de valencia no está llena, el elemento es reactivo, lo que significa que puede formar un enlace químico con el átomo de otro elemento. Cada átomo comparte sus electrones de valencia en un intento de llenar la capa de valencia. 

El hidrógeno (H) y el helio (He) tienen 1 capa, mientras que el francio (Fr) tiene 7. Los lantánidos y actínidos se agrupan y enumeran debajo de la tabla principal. Todos los lantánidos pertenecen al Período 6, Grupo 3 y todos los actínidos pertenecen al Período 7, Grupo 3. 
Grupo 1: 1 electrón de valencia Grupo 2: 2 electrones de valencia Grupo 13: 3 electrones de valencia Grupo 14: 4 electrones de valencia Grupo 15: 5 electrones de valencia Grupo 16: 6 electrones de valencia Grupo 17: 7 electrones de valencia Grupo 18: 8 electrones de valencia – excepto Helio, que tiene 2 

Grupo 3: 3 electrones de valencia Grupo 4: 2 a 4 electrones de valencia Grupo 5: 2 a 5 electrones de valencia Grupo 6: 2 a 6 electrones de valencia Grupo 7: 2 a 7 electrones de valencia Grupo 8: 2 o 3 electrones de valencia Grupo 9: 2 o 3 electrones de valencia Grupo 10: 2 o 3 electrones de valencia Grupo 11: 1 o 2 electrones de valencia Grupo 12: 2 electrones de valencia
Determinación del número de electrones de valencia
Contenido
Los electrones de valencia se encuentran en la capa más externa de un elemento. El número de electrones de valencia en un átomo determina el tipo de enlace químico que este elemento puede formar. La mejor manera de averiguar el número de electrones de valencia es utilizando la tabla periódica de los elementos.
Pasos
Método 1 de 3: Primera parte: comprensión de las capas de electrones

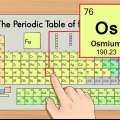
1. La Tabla Periódica de los Elementos. Esta es una tabla de códigos de colores, en la que cada celda muestra un elemento con su número atómico y de 1 a 3 letras como símbolo.

2. Encuentre el número atómico del elemento. El número atómico está arriba o al lado del símbolo del elemento. Por ejemplo: el boro (B) tiene número atómico 5, lo que significa que tiene 5 protones y 5 electrones.

3. Dibuja una representación simple de un átomo y coloca los electrones en órbita alrededor del núcleo. Estas órbitas también se denominan capas o niveles de energía. El número máximo de electrones que pueden estar en la misma capa es fijo, y las capas se llenan desde la órbita más interna hasta la más externa.

4. Encuentre el número de electrones en la capa externa. Estos son los electrones de valencia.
Método 2 de 3: Parte dos: encontrar electrones de valencia en metales excepto metales de transición

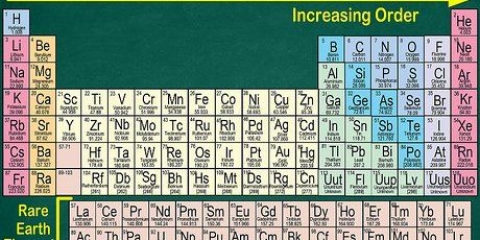
1. Numera cada columna de la tabla periódica, del 1 al 18. El hidrógeno (H) está en la parte superior de la columna 1 y el helio (He) está en la parte superior de la columna 18. Estos son los diferentes grupos de elementos.

2. Numere cada fila, del 1 al 7. Estos son los períodos de los elementos, y corresponden al número de capas o niveles de energía de un átomo.

3. Localizar un elemento que no sea un metal de transición. Los metales de transición están en los grupos 3 a 12. Los números de grupo de los otros metales indican el número de electrones de valencia.
Método 3 de 3: Parte tres: encontrar electrones de valencia en metales de transición

1. Encuentre un elemento de los grupos 3 a 12, los metales de transición.

2. Determine el número de electrones de valencia según el número de grupo. Estos números de grupo corresponden a un posible número de electrones de valencia.
Consejos
- Los metales de transición pueden tener capas de valencia que no están completamente llenas. Determinar el número exacto de electrones de valencia en los metales de transición requiere ciertos principios de la teoría cuántica que están más allá del alcance de este artículo.
Artículos de primera necesidad
- Tabla Periódica de los Elementos
- Lápiz
- Papel
Artículos sobre el tema. "Determinación del número de electrones de valencia"
Оцените, пожалуйста статью
Similar
Popular