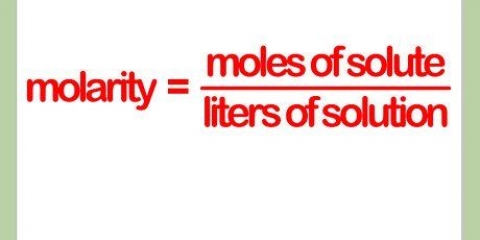Puede ser útil colocar un signo de interrogación frente a la unidad que necesita determinar para ayudarlo a resolverlo. Sigamos con nuestro ejemplo. Usamos nuestros valores de muestra de la siguiente manera: C1V1=C2V2 (5 M)V1=(1mM)(1L). Nuestras dos concentraciones tienen unidades diferentes. Detengámonos aquí y pasemos al siguiente paso. 
En nuestro ejemplo usamos diferentes unidades para la concentración M (molar) y mM (milimolar). Convirtamos nuestra segunda medida a M: 1mM × 1M/1000mM =0.001M 
Continuamos con nuestro problema de ejemplo: (5 M)V1=(1mM)(1L). Vamos a V1 resuelve con nuestras nuevas unidades. (5 M)V1=(0.001M)(1L) V1=(0.001M)(1L)/(5M). V1=0,0002 l o 0,2 ml 
Medir el volumen V1 de la solución con concentración C1. Luego agregue suficiente diluyente (agua, etc.).), a un volumen total de V2. Esta nueva solución le dará la concentración deseada (C2). En nuestro ejemplo, por ejemplo, primero mide 0,2 ml de la solución de nuestra solución 5 M. Luego agregue suficiente agua para aumentar el volumen de la solución a 1 l: 1 l - 0,0002 l = 0,9998 l o 999,8 ml. En otras palabras, agregamos 999.8 ml de agua a nuestra pequeña muestra de la solución. La nueva solución diluida tiene una concentración de 1 mM, que es lo que queríamos lograr en primer lugar. 

Por ejemplo, si queremos diluir 1 taza de jugo de naranja concentrado a la cuarta parte de la concentración inicial, agregamos 3 tazas añadir agua al concentrado. Nuestra mezcla final tendrá 1 taza de concentrado por 4 tazas del líquido total, una cuarta parte de la concentración inicial. He aquí un ejemplo más complejo: si 2/3 taza de cierto concentrado a un cuarto de la concentración inicial, le agregamos 2 tazas de agua, porque 2/3 de taza es un cuarto de 2&2/3 tazas de liquido total. Asegúrese de agregar las sustancias a un recipiente lo suficientemente grande para el volumen final que desea: un tazón grande o un recipiente similar. 
Soluciones diluyentes
Contenido
La dilución es el proceso de hacer que una solución concentrada sea menos concentrada. Hay una serie de razones por las que uno podría querer realizar una dilución, que van desde las más graves hasta las más generales. Por ejemplo, los bioquímicos hacen nuevas soluciones diluidas de su forma concentrada para usar en sus experimentos, mientras que en el otro extremo del espectro, un cantinero diluye los licores con un refresco o jugo para hacer un cóctel más sabroso. La fórmula formal para calcular una dilución es C1V1=C2V2, donde C1 y C2 representan las concentraciones de las soluciones inicial y final, respectivamente, y V1 y V2 representan sus volúmenes.
Pasos
Método 1 de 2: Dilución precisa de concentrados con la ecuación de dilución

1. Determina lo que sabes y lo que no sabes. Realizar una dilución en química generalmente significa tomar una pequeña cantidad de una solución de concentración conocida y luego agregar un líquido neutro (como agua) para hacer una nueva solución de mayor volumen, pero menor concentración. Esto sucede a menudo en los laboratorios porque, por razones de eficiencia, los reactivos a menudo se almacenan en concentraciones relativamente altas que se diluyen para su uso en experimentos. En la práctica, generalmente sabrá la concentración inicial de la solución y la concentración y el volumen de su segunda solución deseada, pero no el volumen de la primera solución que desea utilizar para llegar allí.
- En otras situaciones (especialmente en las tareas escolares), es posible que deba encontrar otra pieza del rompecabezas, por ejemplo, es posible que se le haya dado un volumen y una concentración originales, con instrucciones para determinar la concentración final si puede diluir la solución a un cierto volumen. En el caso de una dilución, es útil hacer una descripción general de las variables conocidas y desconocidas antes de comenzar.
- Abordemos un problema de ejemplo. Suponga que la tarea es diluir una solución de 5 M con agua para hacer 1 l de 1 mM-para hacer la solución. En este caso, conocemos la concentración de la solución inicial y el volumen y la concentración objetivo que queremos lograr, pero no qué cantidad de la solución original (que vamos a diluir con agua) necesitamos para llegar allí.
- Recordatorio: en química, M es una medida de concentración llamada Molaridad, o el número de moles de una sustancia por litro.

2. Usa tus valores en la fórmula C1V1=C2V2. En esta fórmula, C. es1 la concentración de la solución inicial, V1 el volumen de la solución inicial, C2 la concentración de la solución final y V2 el volumen de la solución final. Usar los valores dados en esta ecuación debería darte el valor desconocido con un mínimo de esfuerzo.

3. Permita cualquier diferencia en las unidades. Dado que las diluciones conducen a cambios en la concentración (que a veces pueden ser bastante grandes), no es raro que dos variables en su ecuación tengan unidades diferentes. Si bien esto se pasa por alto fácilmente, las unidades que no coinciden en su ecuación pueden conducir a una respuesta en varios órdenes de magnitud. Antes de resolver el problema, debe verificar todos los valores con diferentes unidades de concentración y/o volumen para convertir.

4. Resolver. Cuando todas las unidades coincidan, resuelve la ecuación. Esto casi siempre se puede hacer con álgebra simple.

5. Entender cómo usar esta respuesta de manera práctica. Suponga que ha encontrado su valor faltante, pero tiene dudas sobre la aplicación de estos nuevos datos a una dilución que realmente desea realizar. Esto es comprensible: el lenguaje de las matemáticas y la ciencia a veces no se presta bien al mundo real. Si pones los cuatro valores en la ecuación C1V1=C2V2 sabe, realice la dilución de la siguiente manera:
Método 2 de 2: hacer diluciones fáciles y prácticas

1. Lea la información en el empaque. Hay muchas razones por las que es posible que desee hacer una dilución en casa, en la cocina o en cualquier otro lugar que no sea un laboratorio. Por ejemplo, el simple acto de hacer jugo de naranja a partir de concentrado es una dilución. En muchos casos, los productos que requieren dilución contendrán más información sobre la dilución en el empaque. Incluso pueden dar instrucciones precisas a seguir. Aquí hay algunas cosas a tener en cuenta al buscar información:
- El volumen del producto a utilizar
- El volumen del diluyente a utilizar
- El tipo de diluyente a utilizar (normalmente agua)
- Instrucciones especiales de mezcla
- probablemente lo harás No ver información sobre las concentraciones exactas de los líquidos que se utilizan. Esta información es superflua para el consumidor medio.

2. Agregar el diluyente a la solución concentrada. Para diluciones caseras simples, como las que puede hacer en la cocina, todo lo que realmente necesita saber antes de comenzar es la cantidad de concentrado que está usando y la concentración final aproximada que desea obtener. Diluya el concentrado con la cantidad adecuada de diluyente (que se determina en relación con el volumen inicial del concentrado utilizado. Vea abajo:

3. Puede ignorar el volumen de polvos en la mayoría de los casos. El polvo (como ciertas mezclas de bebidas) que se agrega a los líquidos generalmente no debe considerarse una "dilución". El cambio de volumen debido a la adición de una pequeña cantidad de polvo a un líquido suele ser lo suficientemente pequeño como para ignorarlo. En otras palabras, al agregar pequeñas cantidades de polvo a un líquido, simplemente está agregando el polvo al volumen final de líquido que desea lograr.
Advertencias
- Siga todas las pautas de seguridad según lo indique la empresa fabricante o su empresa. Esto es especialmente importante si Ud quiero diluir una solución ácida.
- Trabajar con una solución ácida puede requerir pasos más detallados y pautas de seguridad que diluir soluciones no ácidas.
Artículos sobre el tema. "Soluciones diluyentes"
Оцените, пожалуйста статью
Popular