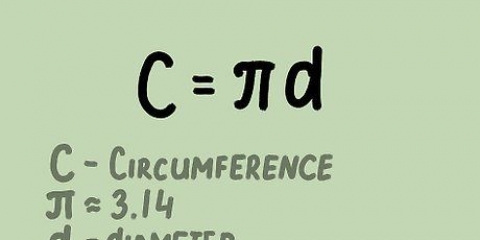Ejemplo de tarea: Mol = 0,75 moles de NaCl Volumen = 4,2 L 
Problema de ejemplo: molaridad = 0,75 mol / 4.2L = 0.17857142 
Ejemplo de asignación: NaCl 0,179 M 

Ejemplo de tarea: Masa = 3,4 g KMnO4 Volumen = 5,2 L 
Ejemplo de tarea: La masa molar de K = 39,1 g La masa molar de Mn = 54,9 g La masa molar de O = 16,0 g Masa molar total = K + Mn + O + O + O + O = 39,1 + 54.9 + 16 + 16 + 16 + 16 = 158,0 gramos 
Problema de ejemplo: gramos de sustancia * (1/masa molar de la sustancia) = 3,4 g * (1 mol / 158 g) = 0,0215 mol 
Problema de ejemplo: molaridad = 0.0215 mol / 5.2L = 0.004134615 
Ejemplo de tarea: 0,004 M KMnO4 

Ejemplo de tarea: Número de moles = 1,2 moles de CaCl2 Volumen = 2905ml 
Declaración de ejemplo: 2905 ml * (1 L / 1000 ml) = 2905 L 
Asignación de ejemplo: 1,2 mol CaCl2 / 2905L = 0,413080895 
Ejemplo de asignación: CaCl 0,413 M2 

La masa molar de Na = 22,99 g La masa molar de Cl = 35,45 g La masa molar de NaCl = 22.99 + 35.45 = 58,44 gramos 
Mol NaCl = 5,2 g NaCl * (1 mol / 58,44 g) = 0,08898 mol = 0,09 mol 
También puede ver esto como multiplicar 800 ml por un factor de conversión de 1 L / 1000 ml. Para hacer esto rápidamente, todo lo que necesita hacer es mover el punto decimal 3 dígitos hacia la izquierda, en lugar de calcular esto. Volumen = 800 ml * (1 L / 1000 ml) = 800 ml / 1000 ml = 0,8 L 
Molaridad = número de moles de sustancia / número de litros de solución = 0,09 mol / 0,8 L = 0,1125 mol/L 
Respuesta: NaCl 0,11 M
Cálculo de la molaridad de una solución
Contenido
La molaridad es una descripción de la relación entre el número de moles de un líquido y su volumen. Para calcular la molaridad se empieza con moles y volumen, masa y volumen o moles y mililitros. Estas variables luego se completan en la fórmula de cálculo de molaridad estándar para (con suerte) obtener la respuesta correcta.
Pasos
Método 1 de 4: calcular la molaridad usando moles y volumen

1. Aprenda la fórmula estándar para calcular la molaridad. La molaridad es igual al número de moles de un soluto dividido por el volumen de la solución en litros. Esto ya está escrito: molaridad = número de moles de sustancia / número de litros de solución
- Ejemplo de tarea: ¿Cuál es la molaridad de una solución de 0,75 mol de NaCl en 4,2 litros de agua??

2. Ver la tarea. Calcular la molaridad requiere una cierta cantidad de moles de sustancia y una cantidad de litros de solución. Si la declaración proporciona estas cifras, entonces no es necesario realizar ningún trabajo preparatorio.

3. Divide el numero de moles por el numero de litros. La fracción que obtienes da el número de moles por litro de solución, también conocido como molaridad.

4. Escribe tu respuesta. Complete la respuesta correctamente, según sus datos de medición y los requisitos del problema. Corta la palabra "molaridad" con "metro" y usa el nombre químico del soluto.
Método 2 de 4: calcular la molaridad con masa y volumen

1. Conoces la fórmula estándar para calcular la molaridad.molaridad = número de moles de sustancia / número de litros de solución
- Problema de ejemplo: ¿Cuál es la molaridad de una solución al disolver 3,4 g de KMnO4 en 5,2 litros o agua?

2. Ver la tarea. Calcular la molaridad requiere una cierta cantidad de moles de sustancia y una cantidad de litros de solución. Si la declaración no proporciona estas cifras, se debe realizar un trabajo preliminar antes de poder continuar.

3. Determinar la masa molar del soluto. Para encontrar los moles del soluto, primero es necesario calcular la masa molar. Esto se hace sumando las diferentes masas molares de cada elemento de la sustancia. Esta masa molar se puede encontrar usando la tabla periódica.

4. Convertir gramos a moles. Ahora que conoce la masa molar del soluto, aún es necesario convertirla al número de mol. Esto se hace determinando cuánto pesa 1 mol de la sustancia y luego multiplicándolo por la masa molar.

5. Divide el número de moles por el número de litros de solución para encontrar la molaridad.

6. Escribe tu respuesta. Complete la respuesta correctamente, según sus datos de medición y los requisitos del problema. Corta la palabra "molaridad" con "metro" y usa el nombre químico del soluto.
Método 3 de 4: calcular la molaridad usando moles y mililitros

1. Conoces la fórmula estándar para calcular la molaridad.molaridad = número de moles de sustancia / número de litros de solución. Si el volumen se da en mililitros, tendrás que convertirlo.
- Problema de ejemplo: ¿Cuál es la molaridad de una solución de 1,2 mol CaCl2 en 2905 mililitros de agua?

2. Ver la tarea. Calcular la molaridad requiere una cierta cantidad de moles de sustancia y una cantidad de litros de solución. Si la declaración no proporciona estas cifras, se debe realizar un trabajo preliminar antes de poder continuar.

3. Convertir el número de mililitros a litros. Encuentra la cantidad de litros de la solución dividiendo el volumen por 1000, o moviendo el punto decimal 3 dígitos a la izquierda.

4. Divide el numero de moles por el numero de litros. Ahora que tienes todos los números seguidos puedes calcular la molaridad de la solución.

5. Escribe tu respuesta. Complete la respuesta correctamente, según sus datos de medición y los requisitos del problema. Corta la palabra "molaridad" con "metro" y usa el nombre químico del soluto.
Método 4 de 4: problema de práctica adicional

1. Queremos determinar la molaridad de una solución de 5,2 g de NaCl en 800 ml de agua. Primero enumere estos valores para mayor claridad: masa en gramos y volumen en mililitros.
- Masa = 5,2 g NaCl
- Volumen = 800 ml de agua

2. Determinar la masa molar de NaCl. Esto se hace sumando la masa molar de sodio (Na) y la masa molar de cloro (Cl).

3. Multiplique la masa de la sustancia por el factor de conversión de la masa molar. En este ejemplo, la masa molar de NaCl es 58.44 g, entonces tienes 1 mol / 58,44 g.

4. Divide 800 ml de agua entre 1000 para obtener la cantidad de litros.

5. Divide los moles de una sustancia por los litros de la solución. Para encontrar la molaridad, divide 0,09 mol de la sustancia NaCl por 0,8 L de la solución.

6. Haz tu respuesta más clara. Redondea tu respuesta a dos o tres decimales y abrevia la molaridad a “M.”
Artículos sobre el tema. "Cálculo de la molaridad de una solución"
Оцените, пожалуйста статью
Popular