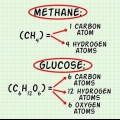
En este ejemplo, una molécula de oxígeno contiene ( ) dos átomos de oxígeno.
) dos átomos de oxígeno. La masa molar de un átomo de oxígeno es de aproximadamente 16 g/mol. Si es necesario, puede calcular valores más precisos. 2 átomos de oxígeno x 16 g/mol por átomo = 32 g/mol  .
. El otro reactivo, la glucosa ( ) tiene una masa molar de (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
) tiene una masa molar de (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol. Si quieres ver este paso con más detalle, lee Cálculo de la masa molar. 
Por ejemplo, suponga que comienza con 40 gramos de oxígeno y 25 gramos de glucosa. 40g  / (32 g/mol) = 1,25 mol de oxígeno.
/ (32 g/mol) = 1,25 mol de oxígeno. 25g  / (180 g/mol) = alrededor de 0,139 mol de glucosa.
/ (180 g/mol) = alrededor de 0,139 mol de glucosa. 
En el siguiente ejemplo, comienza con 1,25 moles de oxígeno y 0,139 moles de glucosa. Entonces, la proporción de moléculas de oxígeno y glucosa es 1.25/0.139 = 9.0. Esta proporción significa que tienes nueve veces más moléculas de oxígeno que de glucosa. 
Para esta reacción, los reactivos se dan como  . Los coeficientes indican que se necesitan seis moléculas de oxígeno por cada molécula de glucosa. La proporción ideal para esta reacción es 6 oxígeno / 1 glucosa = 6,0.
. Los coeficientes indican que se necesitan seis moléculas de oxígeno por cada molécula de glucosa. La proporción ideal para esta reacción es 6 oxígeno / 1 glucosa = 6,0. 
En el siguiente ejemplo, comienza con nueve veces más oxígeno que glucosa, medido por el número de moles. La fórmula le dice que su proporción ideal es seis veces más oxígeno que glucosa. Entonces necesitas más oxígeno que glucosa. Entonces, el otro reactivo, la glucosa en este caso, es el reactivo limitante. 

En el ejemplo anterior, la glucosa es el reactivo limitante. Según los cálculos de la masa molar, los primeros 25 g de glucosa equivalen a 0,139 mol de glucosa. 
La reacción de equilibrio para este ejemplo es  →
→  . Esta ecuación te dice que puedes esperar seis moléculas del producto deseado, dióxido de carbono (
. Esta ecuación te dice que puedes esperar seis moléculas del producto deseado, dióxido de carbono ( ), y una molécula de glucosa (
), y una molécula de glucosa ( ).
). La proporción de dióxido de carbono y glucosa es 6/1 = 6. En otras palabras, esta reacción puede producir seis moléculas de dióxido de carbono a partir de una molécula de glucosa. 
En este ejemplo, los 25 g de glucosa equivalen a 0,139 moles de glucosa. La proporción de dióxido de carbono y glucosa es de 6:1. Espera poder producir seis veces más moles de dióxido de carbono que los moles de glucosa con los que comenzó. El rendimiento teórico de dióxido de carbono es (0,139 mol de glucosa) x (6 mol de dióxido de carbono/mol de glucosa) = 0,834 mol de dióxido de carbono. 
En el siguiente ejemplo, la masa molar de CO es2 alrededor de 44 g / mol. (La masa molar del carbono es ~12 g/mol y la del oxígeno ~16 g/mol, por lo que el total es 12 + 16 + 16 = 44). Multiplique 0.834 mol CO2 x 44 g/mol CO2 = ~36,7 gramos. El rendimiento teórico del experimento es de 36,7 gramos de CO2. 
En este ejemplo, el agua es el segundo producto  . De acuerdo con la reacción de equilibrio, puede esperar seis moléculas de agua de una molécula de glucosa. Esta es una proporción de 6:1. Entonces, 0,139 moles de glucosa deberían dar como resultado 0,834 moles de agua.
. De acuerdo con la reacción de equilibrio, puede esperar seis moléculas de agua de una molécula de glucosa. Esta es una proporción de 6:1. Entonces, 0,139 moles de glucosa deberían dar como resultado 0,834 moles de agua. Multiplica los moles de agua por la masa molar de agua. La masa molar es 2 + 16 = 18 g/mol. Multiplicado por el producto, esto da como resultado 0.139 mol H2O x 18 g/mol H2O = ~2,50 gramos. El rendimiento teórico de agua en este experimento es de 2,50 gramos.
Cálculo del rendimiento teórico
Contenido
El rendimiento teórico es un término usado en química para la cantidad máxima de una sustancia obtenida que se espera de una reacción química. Empiezas balanceando una ecuación de reacción y definiendo el reactivo limitante. Cuando mide la cantidad de reactivo que desea utilizar, puede calcular la cantidad de una sustancia obtenida. Este es el rendimiento teórico de la ecuación. En un experimento real, probablemente perderá algo porque no es un experimento ideal.
Pasos
Parte 1 de 2: Determinación del reactivo limitante

1. Comience con una reacción de equilibrio. Una ecuación de reacción se parece a una receta. Muestra qué reactivos (a la izquierda) reaccionan entre sí para producir productos (a la derecha). Una reacción en equilibrio tendrá el mismo número de átomos en el lado izquierdo de la ecuación (como reactivos) que en el lado derecho (en forma de productos).
- Por ejemplo, supongamos que tenemos la ecuación simple
→
. Hay dos átomos de hidrógeno a la izquierda y a la derecha. Pero hay dos átomos de oxígeno como reactivo a la izquierda y solo un átomo como producto a la derecha.
- Para balancear la ecuación, duplicamos el producto y obtenemos
→
.
- Consultar el saldo. Este cambio ha hecho que el oxígeno lata, porque ahora tiene dos átomos a ambos lados. Pero ahora tienes dos átomos de hidrógeno a la izquierda con cuatro átomos de hidrógeno a la derecha.
- Duplicar el hidrógeno en el reactivo. Esto hace que la ecuación
→
. Este cambio ahora ha resultado en cuatro átomos de hidrógeno y dos átomos de oxígeno en cada lado. la ecuacion esta en equilibrio.
- Un ejemplo más complicado: el oxígeno y la glucosa pueden reaccionar para formar dióxido de carbono y agua:
→
En esta ecuación, cada lado tiene exactamente 6 átomos de carbono (C), 12 átomos de hidrógeno (H) y 18 átomos de oxígeno (O). la ecuacion esta en equilibrio. - Lee este artículo si quieres comprobar las ecuaciones de reacción más a fondo.

2. Calcular la masa molar de cada reacción. Usando la tabla periódica u otro libro de referencia, encuentre la masa molar de cada átomo en cada compuesto. Súmalos para encontrar la masa molar de cada compuesto de reactivos. Haga esto para una sola molécula de la composición. Eche otro vistazo a la ecuación de la conversión de oxígeno y glucosa en dióxido de carbono y agua:  →
→ 
 →
→ 
 ) dos átomos de oxígeno.
) dos átomos de oxígeno. .
. ) tiene una masa molar de (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
) tiene una masa molar de (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
3. Convertir la cantidad de cada reactivo de gramos a mol. Para un experimento real, se conocerá la masa en gramos de cada reactivo que utilice. Divida este valor por la masa molar de esa sustancia como conversión al número de mol.
 / (32 g/mol) = 1,25 mol de oxígeno.
/ (32 g/mol) = 1,25 mol de oxígeno. / (180 g/mol) = alrededor de 0,139 mol de glucosa.
/ (180 g/mol) = alrededor de 0,139 mol de glucosa.
4. Determinar la relación molar de los reactivos. Un mol es una herramienta de cálculo utilizada en química para contar moléculas en función de su masa. Al determinar los moles de oxígeno y glucosa, sabe con cuántas moléculas de cada uno comienza. Para encontrar la relación de los dos, divida los moles de un reactivo por el del otro.

5. Determine la relación ideal para la reacción. Mira la reacción de equilibrio. Los coeficientes de cada molécula le indican la proporción de moléculas que necesita para que se produzca la reacción. Si usa exactamente la proporción dada por la fórmula, entonces ambos reactivos deben usarse por igual.
 . Los coeficientes indican que se necesitan seis moléculas de oxígeno por cada molécula de glucosa. La proporción ideal para esta reacción es 6 oxígeno / 1 glucosa = 6,0.
. Los coeficientes indican que se necesitan seis moléculas de oxígeno por cada molécula de glucosa. La proporción ideal para esta reacción es 6 oxígeno / 1 glucosa = 6,0.
6. Compare las proporciones para encontrar el reactivo limitante. En la mayoría de las reacciones químicas, uno de los reactivos se agotará antes que el otro. El reactivo que se consume primero se llama reactivo limitante. Este reactivo limitante determina cuánto tiempo puede continuar la reacción química y el rendimiento teórico que puede esperar. Compare las dos proporciones que calculó para determinar el reactivo limitante:
Parte 2 de 2: Determinación del rendimiento teórico

1. Ver el comentario para encontrar el producto deseado. El lado derecho de una ecuación química muestra los productos que produce la reacción. Si la reacción está balanceada, los coeficientes de cada producto indican cuántos de cada relación molecular esperar. Cada producto tiene un rendimiento teórico, o la cantidad de producto que esperaría cuando la reacción se complete por completo.
- Continuando con el ejemplo anterior, analiza la reacción
→
. Los dos productos de la derecha son dióxido de carbono y agua.
- Puede comenzar con cualquier producto si desea calcular el rendimiento teórico. En algunos casos es posible que solo estés interesado en uno de los dos productos. Si es así, ese es el que usted va a empezar con.

2. Escribe los moles de tu reactivo limitante. Siempre debe comparar el número de moles de reactivo limitante con el número de moles de un producto. Si intentas comparar la masa de cada uno, no obtendrás el resultado correcto.

3. Compare la relación entre las moléculas en el producto y el reactivo. Vuelta a la reacción de equilibrio. Divida el número de moléculas de su producto deseado por el número de moléculas de su reactivo limitante.
 →
→  . Esta ecuación te dice que puedes esperar seis moléculas del producto deseado, dióxido de carbono (
. Esta ecuación te dice que puedes esperar seis moléculas del producto deseado, dióxido de carbono ( ), y una molécula de glucosa (
), y una molécula de glucosa ( ).
).
4. Multiplique esta relación por el número de moles del reactivo limitante. La respuesta es el rendimiento teórico, en moles, del producto deseado.

5. Convierte el resultado a gramos. Este es el inverso de su paso anterior de calcular el número de moles o la cantidad de reactivo. Si conoce la cantidad de moles que debe esperar, multiplíquela por la masa molar del producto para determinar el rendimiento teórico en gramos.

6. Repita el cálculo para el otro producto, si lo desea. En muchos experimentos, es posible que solo esté interesado en la eficiencia de un determinado producto. Si quieres saber el rendimiento teórico de ambos productos, solo tienes que repetir el proceso.
 . De acuerdo con la reacción de equilibrio, puede esperar seis moléculas de agua de una molécula de glucosa. Esta es una proporción de 6:1. Entonces, 0,139 moles de glucosa deberían dar como resultado 0,834 moles de agua.
. De acuerdo con la reacción de equilibrio, puede esperar seis moléculas de agua de una molécula de glucosa. Esta es una proporción de 6:1. Entonces, 0,139 moles de glucosa deberían dar como resultado 0,834 moles de agua.Artículos sobre el tema. "Cálculo del rendimiento teórico"
Оцените, пожалуйста статью
Similar
Popular