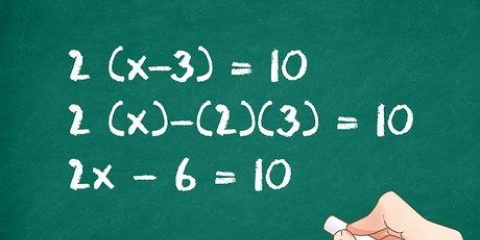Lado izquierdo: 3 carbono, 8 hidrógeno y 2 oxígeno Lado derecho: 1 carbono, 2 hidrógeno y 3 oxígeno El coeficiente 3 para el carbono de la derecha significa 3 carbonos, al igual que el subíndice 3 de la izquierda significa 3 carbonos. En una ecuación química puedes cambiar los coeficientes, pero nunca debes cambiar los subíndices. A la derecha agregamos 4 como coeficiente, porque el subíndice mostraba que ya teníamos 2 átomos de hidrógeno. Cuando multiplicas el coeficiente 4 por el subíndice 2, obtienes 8. Los átomos de carbono, hidrógeno y oxígeno están en equilibrio. Tu ecuación está lista.
Hacer una ecuación de reacción correcta
Contenido
Una ecuación química es una representación teórica o escrita de lo que sucede durante una reacción química. La ley de conservación de la masa dice que los átomos no pueden crearse ni destruirse en una reacción química, por lo que el número de átomos en los reactivos debe equilibrarse con el número de átomos en los productos. Sigue esta guía para aprender a balancear ecuaciones químicas.
Pasos
1. Escriba su ecuación dada. Para este ejemplo usamos: C3eh8 + O2 --> eh2O + CO2

2. Escribe el número de átomos que tienes en cada lado de la ecuación. Mire los subíndices al lado de cada átomo para averiguar el número de átomos en la ecuación.
3. Guarde siempre el hidrógeno y el oxígeno para el final. Esto significa que primero debes equilibrar el átomo de carbono. Agregue un coeficiente al átomo de carbono único en el lado derecho de la ecuación, para equilibrarlo con los 3 átomos de carbono en el lado izquierdo de la ecuación.
C3eh8 + O2 → H2O + 3CO2
C3eh8 + O2 → H2O + 3CO2
4. Luego equilibrar los átomos de hidrógeno. Tienes 8 a la izquierda, entonces debes tener 8 a la derecha.
C3eh8 + O2 → 4eh2O + 3CO2
C3eh8 + O2 → 4eh2O + 3CO2
5. Por último, equilibrar los átomos de oxígeno. Como agregamos coeficientes a las moléculas en el lado derecho de la ecuación, la cantidad de átomos de oxígeno ha cambiado. Ahora tenemos 4 átomos de oxígeno en la molécula de agua y 6 átomos de oxígeno en la molécula de dióxido de carbono. Eso da un total de 10 átomos de oxígeno. Agregue un coeficiente de 5 a la molécula de oxígeno en el lado izquierdo de la ecuación. Ahora tienes 10 moléculas de oxígeno en cada lado.
C3eh8 + 5O2 → 4H2O + 3CO2.
C3eh8 + 5O2 → 4H2O + 3CO2.
Consejos
- Si está atascado, puede ingresar la ecuación en un programa de equilibrio en línea. Tenga en cuenta que no puede acceder a dicho programa durante un examen, así que no se vuelva dependiente de él.
Advertencias
- Nunca use fracciones como coeficientes en una ecuación química: nunca tiene la mitad de una molécula o la mitad de un átomo en una reacción química. Para deshacerse de las fracciones, multiplique la ecuación completa (ambos lados izquierdo y derecho) por el número en el divisor de su fracción.
Artículos sobre el tema. "Hacer una ecuación de reacción correcta"
Оцените, пожалуйста статью
Similar
Popular