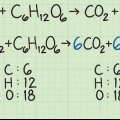
Si hay números al lado de los reactivos, estos son los coeficientes. Estos representan la proporción en la que se incorporan los reactivos. El reactivo limitante es el material de partida que se agotará primero. En reacciones con múltiples materiales de partida, la reacción se detendrá tan pronto como se agote uno de los materiales de partida, a menos que todos los materiales de partida se absorban en la misma proporción. 
Para calcular la masa molar de una molécula, se suman las masas atómicas de cada átomo en la sustancia. La masa atómica es el número debajo del símbolo químico en la tabla periódica. Recuerda que todos los subíndices de una molécula significan que esos átomos son más frecuentes. 
Si la relación real es mayor que la estequiométrica, entonces el reactivo en el numerador es mayor, lo que significa que el otro reactivo es el factor limitante. Si la relación real es menor que la estequiométrica, entonces el reactivo en el numerador es solo el factor limitante. 
Calcula el número de moles de una sustancia producida por reactivos dados, multiplicando el número de moles de un reactivo por la relación coeficiente producto/coeficiente del reactivo. Haz esto para cada reactivo. 







Calcular el rendimiento de la reacción
Contenido
En química, la rendimiento de la reacción si se eficiencia de reacción la cantidad de sustancia producida por una reacción química. Eso retorno teórico es la cantidad máxima de sustancia que se puede producir en una reacción perfectamente eficiente. En realidad, la mayoría de las reacciones están lejos de ser perfectas: la eficiencia de una reacción suele ser menor de lo que es teóricamente posible. Para expresar la eficiencia de una reacción, calcule la eficiencia de la reacción con la fórmula: % retorno = (retorno real/retorno teórico) x 100.
Pasos
Parte 1 de 3: determinar el reactivo limitante

1. Empieza a escribir la ecuación química. Esto servirá como una representación matemática de la reacción final.
- Si no está seguro de cómo escribir una ecuación química, consulte los wikiHow sobre este tema.

2. Determine con qué reactivos está tratando. Estos suelen estar a la izquierda de la flecha en la ecuación. Estos también se denominan con el término "materiales para empezar." Es posible (como en la parte 2) que solo haya un reactivo.

3. Calcular la cantidad (en moles) de cada reactivo. Para hacer esto, divida la masa de cada reactivo por su masa molar.

4. Si tiene dos reactivos, compare la relación de los moles con la de los coeficientes. Estas proporciones se denominan respectivamente "proporción real" y "relación estequiométrica."

5. Si tiene más de dos reactivos, deberá calcular cuántos moles de cada reactivo se producirán cuando se complete la reacción. El reactivo que produce la menor cantidad es el factor limitante.
Parte 2 de 3: Cálculo del rendimiento teórico

1. Determinar cuál debe ser el producto de una reacción. Esto suele estar en el lado derecho de la flecha en una fórmula química. En este ejemplo, CaO es la sustancia deseada (CO2 es un gas). El rendimiento teórico es una medida de la cantidad de producto que esperamos si la reacción es completamente eficiente.
- Por ejemplo: Clair produce 0,45 g de nitrato de amonio. Predice un rendimiento teórico de 0,50 g. ¿Cuál es el porcentaje de retorno??
- 0,45/0,50= 0,9. Multiplique esto por 100 para el porcentaje.
- Porcentaje de retorno = 90%. Escriba la masa de cada una de sus sustancias iniciales.

2. Convierta la masa del reactivo limitante al número de moles. Haga esto dividiendo la masa del reactivo por la masa molar, como en el paso 3, divida 1.

3. La relación experimental. Divida los moles del producto deseado por los moles del reactivo limitante. Esto se llama la relación experimental.

4. Calcular la masa molar de 1 mol del producto. Registre esta relación en la ecuación, como se describe a continuación.

5. Predecir el retorno teórico. Multiplique el número de moles del reactivo limitante por la relación (coeficiente de producto / coeficiente de reactivo limitante) y multiplique por la masa molar del producto. Esto le da la masa del producto que producirá, si la reacción es perfectamente eficiente (según el rendimiento teórico).
Parte 3 de 3: Cálculo del porcentaje de retorno

1. Deja que la reacción se lleve a cabo. Recoja el producto purificado de su reacción y calcule su masa en una balanza. Tenga en cuenta la masa.

2. Convierta la masa del producto en moles dividiendo por el peso molecular. Lo haces de la misma manera que en el paso 2, parte 2. Registre el número de moles de la sustancia obtenida durante el experimento como el rendimiento real.

3. Calcular el porcentaje de retorno. Dividir la rentabilidad real por la rentabilidad teórica y multiplicar por 100. La respuesta es un porcentaje, que compara la masa del producto con la masa de una reacción ideal (perfecta).
Advertencias
- Es posible calcular un porcentaje de retorno superior al 100%, sin equivocarse en su cálculo. Si el producto final que pesa no es puro (contiene sustancias que no se tuvieron en cuenta en la comparación química), el resultado no será correcto.
- Por eso es importante purificar con precisión su producto mediante filtración, secado, destilación u otra forma, según las propiedades de la sustancia del producto.
Artículos sobre el tema. "Calcular el rendimiento de la reacción"
Оцените, пожалуйста статью
Popular