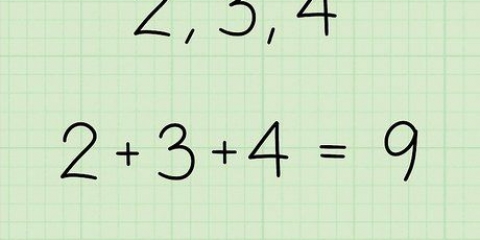Cero significa que la concentración de ese reactivo no afecta la velocidad de reacción. Uno significa que aumentar la concentración de este reactivo aumentará la velocidad de reacción linealmente (duplicar el reactivo duplica la velocidad del reactivo). Dos significa que la velocidad de la reacción aumentará en el cuadrado de la concentración aumentada (duplicar el reactivo aumentará la velocidad cuatro veces). Los reactores cero a menudo no se enumeran en la ecuación de velocidad porque cualquier número elevado a la potencia cero es igual a uno. 
Por ejemplo, supongamos que el primer reactivo es de primer orden (tiene un exponente de 1) y el reactivo dos es de primer orden (también exponente 1), entonces la reacción general es de segundo orden. 







Determinación del orden de una reacción
Contenido
Saber cómo las diferentes concentraciones de productos químicos afectan la velocidad de una reacción es esencial para muchos procesos químicos. El término "orden de reacción" (u orden de reacción) se refiere a cómo la concentración de uno o más reactivos (sustancias químicas) afecta la velocidad de la reacción. El orden final de una reacción es la suma del orden de todos los reactivos presentes. Si bien mirar una ecuación de equilibrio no lo ayudará a determinar el orden de la reacción, puede obtener esta información mirando la ecuación de velocidad o graficando la reacción en cuestión.
Pasos
Método 1 de 3: analizar la ecuación de velocidad

1. Determine la ecuación de velocidad de la reacción. La ecuación de velocidad puede ayudarte a determinar el orden de la reacción. Esta ecuación muestra el aumento o la disminución de una sustancia determinada a lo largo del tiempo. Otras ecuaciones relacionadas con la reacción química no te ayudarán a determinar el orden de la reacción.

2. Verifique el orden de cada reactivo. Cada reactivo en la ecuación de velocidad tendrá un exponente de 0, 1 o 2 (por encima de 2 es muy raro). Ese exponente indica el orden de ese reactivo. Nos fijamos en cada exponente:

3. Sume el orden de todos los reactivos juntos. El orden total de una reacción es la suma del orden de todos los reactivos. Sume los exponentes de cada reactivo para determinar el orden general de la reacción. Este número suele ser menor o igual a dos.
Método 2 de 3: Mostrar puntos de datos como un gráfico

1. Encuentre las variables que hacen un gráfico lineal de la reacción. Un gráfico lineal se refiere a un gráfico que tiene una tasa de cambio constante. En otras palabras, la variable dependiente cambiará tanto en el primer segundo como en el segundo, tercero, etc. Un gráfico lineal parece una línea recta.

2. Grafique la concentración del reactivo frente al tiempo. Esto indica cuánto reactivo queda en un punto dado durante la reacción. Si este gráfico es lineal, significa que la concentración del reactivo no afecta la velocidad a la que procede la reacción. En este caso, el reactivo es de orden cero.

3. Dar el logaritmo natural de la concentración del reactivo frente al tiempo. Si el logaritmo natural del reactivo da como resultado un gráfico lineal, el reactivo es uno de primer orden. Esto significa que la concentración del reactivo afecta la velocidad de reacción. Si el gráfico no es lineal, debe probar el gráfico para una reacción de segundo orden.

4. Trazar [1/concentración de reactivo] frente al tiempo. Un gráfico lineal de [1/concentración de reactivo] indica una reacción de segundo orden. Esto significa que la velocidad de la reacción aumentará por el cuadrado de cualquier aumento en el reactivo. Si este gráfico no es lineal, debe intentar graficar las reacciones de primer orden y cero.

5. Encuentre la suma del orden para todos los reactivos. Una vez que haya encontrado un gráfico lineal para cada reactivo, también sabrá el orden de cada reactivo. Le permite calcular el orden resultante de la reacción. Suma todas las secuencias reactivas. Este es entonces el orden de reacción de toda la reacción.
Método 3 de 3: resolver estudios de casos

1. Determinar el orden de una reacción cuando al duplicar cualquiera de los reactivos se duplica la velocidad. Si al duplicar la concentración de un reactivo se duplica la velocidad, entonces ese reactivo es de primer orden. En este caso, ambos reactivos son de primer orden. La suma de dos reactivos de primer orden es una reacción de segundo orden.

2. Encuentre el orden de una reacción en la que la duplicación de ambos reactivos no cambia la velocidad. Si al cambiar la concentración de un reactivo no se produce un cambio en su velocidad, ese reactivo es de orden cero. En este caso, ambos reactivos son de orden cero. La suma de dos orden cero es un orden de reacción general de orden cero.

3. Determine el orden de una reacción donde al duplicar un reactivo se cuadruplica la velocidad. El reactivo que afecta la velocidad de reacción es de segundo orden. El segundo reactivo no afecta la velocidad y es de orden cero. La suma de las órdenes es dos, por lo que esta es una reacción de segundo orden.
Artículos sobre el tema. "Determinación del orden de una reacción"
Оцените, пожалуйста статью
Similar
Popular