Siga estas reglas en el orden que se indica a continuación: Todo Na, K y NH4 las sales son solubles. Todo NO3, C2eh3O2, Cl O3 y ClO4 las sales son solubles. Todo Ag, Pb y Hg2 las sales no son solubles. Todas las sales de Cl, Br e I son solubles. todo CO3, O, S, OH, PO4, CRO4, cr2O7 y entonces3 las sales no son solubles (con algunas excepciones). Todo tan4 las sales son solubles (con algunas excepciones). 
Por ejemplo, en NaCl, Na es el catión con carga positiva porque es un metal, mientras que Cl es el anión con carga negativa porque es un no metal. 
Si toma un curso de química estándar, probablemente se esperará que memorice algunos de los iones poliatómicos más comunes. Algunos iones de uso común son CO3, NO3, NO2, ENTONCES4, ENTONCES3, Cl O4 y ClO3. Hay muchos más, que puedes encontrar en las tablas de tu libro de texto de química o en línea. 

Si no se indica ningún estado para un elemento, use el estado como se indica en la tabla periódica. Si se dice que un compuesto es una solución, regístrelo como líquido o (ac). Si hay agua en la ecuación, determina si el enlace iónico se disolverá usando una tabla de solubilidad. Si la solubilidad es alta, el compuesto es líquido (ac), si tiene una solubilidad baja, entonces es un sólido (s). Si no hay agua, entonces el enlace iónico es sólido (s). Si el problema se refiere a un ácido o base, entonces el enlace será líquido (ac). Por ejemplo, 2Cr + 3NiCl2 --> 2CrCl3 + 3Ni. Cr y Ni son sólidos en su forma elemental. NiCl2 y CrCl3 son enlaces iónicos solubles, y por lo tanto son líquidos. Si reescribes la ecuación, esto se convierte en: 2Cr(s) + 3NiCl2(ac) --> 2CrCl3(ac) + 3Ni(s). 
Sólidos, líquidos, gases, enlaces moleculares, enlaces iónicos poco solubles, iones poliatómicos y ácidos débiles no se descomponen. Los enlaces iónicos con una alta solubilidad (use una tabla de solubilidad) y los ácidos fuertes se ionizarán al 100% (HCl(ac), HBr(ac), HOLA(ac), eh2ENTONCES4(ac), HClO4(ac) y HNO3(ac)). Tenga en cuenta que aunque los iones poliatómicos no se descomponen más, se separarán de un enlace iónico si son un componente de ese compuesto. 
En nuestro ejemplo: NiCl2 se descompone en Ni y Cl mientras que CrCl3 se descompone en Cr y Cl. Ni tiene una carga de 2+ porque Cl tiene una carga negativa, pero hay 2 átomos de él. Por lo tanto, debe haber un equilibrio entre los 2 iones negativos Cl-. Cr tiene una carga de 3+ porque necesita equilibrar los 3 iones negativos de Cl-. Recuerda que los iones poliatómicos tienen su propia carga específica. 
Sólidos, líquidos, gases, ácidos débiles y enlaces iónicos poco solubles no cambiarán su estado ni se dividirán en iones. Solo déjalos como están. Las sustancias moleculares se dispersarán en una solución de modo que su estado cambie a líquido (ac). Tres excepciones que No líquido (ac) convertirse son: CH4(gramo), C3eh8(gramo) y C8eh18(yo). Continuando con el ejemplo, la ecuación de iones completa queda así: 2Cr(s) + 3Ni(ac) + 6Cl(ac) --> 2Cr(ac) + 6Cl(ac) + 3Ni(s). Cuando Cl no es parte de un compuesto, entonces no es diatómico; así que multiplicamos el coeficiente por el número de átomos en el compuesto, para obtener 6 iones Cl en ambos lados de la ecuación. 
Elabora el ejemplo: hay 6Cl en exceso de iones en cada lado de la ecuación que se pueden eliminar. La ecuación final de iones netos es 2Cr(s) + 3Ni(ac) --> 2Cr(ac) + 3Ni(s). Puede verificar si su respuesta es correcta verificando si las cargas totales en ambos lados de la ecuación de reacción son iguales.
Creación de una ecuación de iones netos
Contenido
Las ecuaciones de iones netos son un aspecto importante de la química, ya que representan solo las entidades que cambian en una reacción química. Se utilizan principalmente en reacciones redox, reacciones de doble sustitución y neutralizaciones ácido-base. Hay tres pasos básicos para escribir una ecuación de iones netos: igualar la ecuación molecular, convertirla en una ecuación de iones completa (cómo existe cada sustancia en una solución) y luego escribir la ecuación de iones netos.
Pasos
Parte 1 de 2: comprensión de los componentes de una ecuación iónica

1. Conoce la diferencia entre molecular yCompuestos iónicos. El primer paso para escribir una ecuación iónica neta es distinguir los enlaces iónicos de la reacción. Los enlaces iónicos son los compuestos que se ionizan en una solución acuosa y tienen carga. Los enlaces moleculares son compuestos que nunca tienen carga. Están formados por dos no metales y a veces se denominan enlaces covalentes.
- Los enlaces iónicos se pueden formar entre metales y no metales, metales e iones poliatómicos o múltiples iones poliatómicos.
- Si no está seguro acerca de un compuesto, busque los elementos del compuesto en la tabla periódica.

2. Determinar la solubilidad de una sustancia. No todos los enlaces iónicos son solubles en una solución acuosa y, por lo tanto, no se descomponen en iones de fosfato individuales. Necesita saber la solubilidad de cada sustancia antes de pasar al resto de la ecuación. A continuación se muestra un breve resumen de las reglas de solubilidad. Encuentre una tabla de solubilidad para obtener más información y excepciones a estas reglas.

3. Determinar el catión y el anión en una composición. Los cationes son los iones positivos en un compuesto y generalmente los metales. Los aniones son los iones no metálicos negativos en el compuesto. Algunos no metales pueden formar cationes, pero los metales siempre forman cationes.

4. Reconocer los iones poliatómicos en la reacción. Los iones poliatómicos son moléculas que están tan estrechamente unidas que no se desintegran en absoluto durante las reacciones químicas. Es importante poder reconocer los iones poliatómicos porque tienen una carga específica y no se descomponen en sus componentes individuales. Los iones poliatómicos pueden tener carga positiva o negativa.
Parte 2 de 2: una ecuación de iones netos

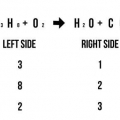
1. Asegúrese de que la ecuación de reacción esté en equilibrio. Antes de que pueda escribir una ecuación de iones netos, primero debe asegurarse de que la ecuación inicial sea completamente esta en equilibrio. Para hacer que una ecuación sea igual en ambos lados de la flecha de reacción, anteponga los coeficientes a los compuestos hasta que haya el mismo número de átomos para cada elemento, en ambos lados de la ecuación.
- Escriba el número de átomos que forman cada compuesto en cada lado de la ecuación.
- Coloque un coeficiente para cada elemento que no sea oxígeno o hidrógeno para equilibrar la ecuación.
- Haz que el número de átomos de hidrógeno sea igual en ambos lados.
- Haz que el número de átomos de oxígeno sea igual en ambos lados.
- Cuente la cantidad de átomos en cada lado de la ecuación nuevamente para asegurarse de que sean iguales.
- Por ejemplo, Cr + NiCl2 --> CrCl3 + Ni se convierte en 2Cr + 3NiCl2 --> 2CrCl3 + 3Ni.

2. Determine los estados de cada compuesto en la ecuación. A menudo podrá señalar palabras clave en una declaración, lo que deja en claro cuál es el estado de cada conexión. Hay una serie de reglas para determinar el estado de un elemento o compuesto.

3. Determine qué especies se descompondrán (en cationes y aniones individuales) en la solución. Cuando una sustancia o compuesto en particular se descompone, se descompone en sus componentes positivo (catión) y negativo (anión). Estos son los componentes que finalmente se equilibran entre sí y, por lo tanto, dan como resultado la ecuación de iones netos.

4. Calcular la carga de cada ion separado. Recuerda que los metales son el catión positivo mientras que los no metales son el anión negativo. Con la tabla periódica puedes determinar qué elemento tiene qué carga. También necesita equilibrar la carga de cada ion dentro del compuesto.

5. Escriba la ecuación con los enlaces iónicos solubles descompuestos en sus iones individuales. Cualquier cosa que se descomponga o se ionice (ácidos fuertes) se dividirá en dos iones diferentes. El estado de la materia sigue siendo el mismo (ac), pero tenga en cuenta que la ecuación permanece en equilibrio.

6. Elimina los iones superfluos eliminando iones idénticos en cada lado de la ecuación. Solo puedes deshacerte de aquellos iones que son completamente idénticos en ambos lados (carga, subíndice, etc.).). Reescribe la reacción sin ninguna de las sustancias eliminadas.
Consejos
- Indique todos los estados de las sustancias en todas las ecuaciones. Definitivamente obtendrá puntos deducidos si no lo hace.
Artículos sobre el tema. "Creación de una ecuación de iones netos"
Оцените, пожалуйста статью
Similar
Popular