Entonces, la masa molar de un elemento es igual a la masa molar de un átomo por el número de átomos en cada molécula: para el hidrógeno, 1,008 por 2, o 2,016 gramos por mol; oxígeno, 15,9994 veces 2, o 31,9988 gramos por mol; y para cloro, 35,453 veces 2, o 70,096 gramos por mol. 

La masa molar de cada elemento de cloruro de hidrógeno, HCl, es 1,008 gramos por mol de hidrógeno y 35,453 gramos por mol de cloro. La masa molar de cada elemento de glucosa, C6eh12O6, es 12,0107 veces 6, o 72,0642 gramos por mol de carbono; 1,008 veces 12, o 12,096 gramos por mol de hidrógeno; y 15,9994 veces 6, o 95,9964 gramos por mol de oxígeno. 
La masa molar del cloruro de hidrógeno es 1.008 + 35.453 o 36.461 gramos por mol. La masa molar de la glucosa es 72,0642 + 12,096 + 95,9964, o 180,1566 gramos por mol.
Cálculo de la masa molar
Contenido
Los átomos son demasiado pequeños para realizar mediciones significativas de sustancias químicas. Para poder trabajar con cantidades muy pequeñas de una determinada sustancia, los científicos las clasifican en unidades de mol. Un mol se define como una cierta cantidad de sustancia con tantas partículas como el número de átomos de carbono en 12 gramos del isótopo C-12, lo que equivale aproximadamente a 6,022 14 × 10. Esto se llama número o constante de Avogadro. Se utiliza para indicar el número de átomos, moléculas, iones o partículas subatómicas en cualquier sustancia, y la masa de 1 mol es la masa molar de esa sustancia. Aquí puedes leer cómo calcular la masa molar de elementos y sustancias.
Pasos
Método 1 de 2: Cálculo de la masa molar de un elemento

1. Encuentre la masa atómica relativa del elemento. La masa atómica relativa de un elemento es el promedio ponderado, expresado en unidades de masa atómica (u), de las masas atómicas de todos los isótopos naturales.Puedes encontrar esta información en la tabla periódica. Como ejemplo, el hidrógeno tiene una masa atómica relativa de 1,008; carbono 12.0107; oxígeno 15,9994; y cloro 35.453.

2. Multiplicar por la masa molar. Esto se define como 1 gramo por mol. Esto convierte la unidad de masa atómica a gramos por mol, lo que hace que la masa molar del hidrógeno sea igual a 1,008 gramos por mol, la del carbono a 12,0107 gramos por mol, al oxígeno a 15,9994 gramos por mol y al cloro a 35,453 gramos por mol.
3. Encuentra la masa molar de una molécula divalente. Algunos elementos solo se pueden encontrar en moléculas de 2 o más. Esto quiere decir que, si quieres calcular la masa molar de un elemento que está formado, por ejemplo, por 2 átomos, como hidrógeno, oxígeno y cloro, determina la masa atómica relativa y multiplícala por la masa molar, y multiplica el resultado por 2.
Método 2 de 2: Cálculo de la masa molar de un compuesto

1. Determinar la fórmula química del compuesto. Este es el número de átomos en cada elemento del compuesto. (Se puede encontrar información sobre esto, por ejemplo, en Binas) Por ejemplo: la fórmula para el cloruro de hidrógeno (ácido clorhídrico) es HCl; para la glucosa C6eh12O6. La última fórmula significa que la glucosa contiene 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno.

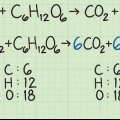
2. Determine la masa molar de cada elemento en el compuesto. Multiplique la masa atómica del elemento por la masa molar y el número de átomos del elemento en el compuesto. Así es como funciona:

3. Sume las masas molares de cada elemento en el compuesto. Esto da la masa molar del compuesto. Así es como se hace:
Consejos
- Mientras que en la mayoría de los casos las masas atómicas relativas tienen una precisión de 4 decimales, en el laboratorio una precisión de 2 decimales o menos es cierta para masas excepcionalmente grandes. Entonces, en el laboratorio, la masa molar del cloruro de hidrógeno es de 36,46 gramos por mol y la de la glucosa es de 180,16 gramos por mol.
Advertencias
- No confundas masa molar y masa molecular. Este último es la masa de una molécula individual de un elemento o compuesto. La masa molar se puede entender como la masa promedio de todas las moléculas en una muestra de una sustancia dada, así como la masa atómica relativa es el promedio de las masas atómicas de todos los isótopos.
Artículos de primera necesidad
- Binas y Tabla Periódica de los Elementos
- Calculadora
Artículos sobre el tema. "Cálculo de la masa molar"
Оцените, пожалуйста статью
Popular