Debido a que los átomos son extraordinariamente pequeños, los científicos generalmente trabajan con átomos en cantidades más grandes llamadas molino. Un mol es la cantidad de una sustancia con tantos átomos como habría en 12 gramos del isótopo carbono-12. Este número es aproximadamente 600 billones (6 por 10 a la potencia 23) de átomos, y se conoce como la constante de Avogadro, en honor al científico que la definió. 


Un libro de referencia dará proporciones basadas en todas las cantidades conocidas de isótopos de un elemento, mientras que el espectrómetro de masas dará las proporciones para la muestra que se está analizando. 
En el ejemplo anterior: 12 x 0,99 = 11,88 para carbono-12 y 13 x 0,01 = 0,13 para carbono-13. La masa atómica relativa es 11,88 + 0,13 = 12,01. (Debido a las proporciones de los isótopos, las masas atómicas relativas en las tablas periódicas rara vez son números enteros.)
Calcular la masa atómica
Contenido
La masa atómica es la masa de un isótopo específico de un átomo dado, pero también se usa incorrectamente para describir el peso promedio de una muestra de diferentes isótopos del mismo elemento, que en realidad se llama masa atómica relativa o peso atómico. Sea cual sea el valor que esté buscando, le mostraremos los pasos para calcular la masa atómica y la masa atómica relativa.
Pasos
Método 1 de 2: calcular la masa atómica

1. Encuentra el número atómico del elemento o isótopo. El número atómico es el número de protones en un elemento, y nunca cambia. Por ejemplo: todos los átomos de hidrógeno, sólo y solo átomos de hidrógeno, tienen un protón. El carbono tiene el número atómico 6 porque su núcleo tiene seis protones, mientras que el oxígeno tiene el número atómico 8 porque su núcleo tiene ocho protones.

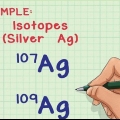
2. Determinar el número de neutrones en el núcleo. El número de neutrones puede variar dentro de un átomo, aunque son el mismo elemento, hay diferentes isótopos de ese elemento. Dos isótopos del mismo elemento tendrán el mismo número de protones, pero diferente número de neutrones.

3. Ignora el número de electrones que orbitan alrededor del núcleo. La masa de electrones de un átomo es insignificante en comparación con los protones y neutrones en el núcleo.

4. Sume el número de protones y neutrones. Esta es la masa atómica de ese átomo.
Método 2 de 2: calcular la masa atómica relativa (peso atómico)

1. Determinar el número de isótopos en la muestra. Los isótopos que se encuentran en la muestra se pueden determinar utilizando un espectrómetro de masas.

2. Determinar la abundancia relativa de cada isótopo en la muestra. Esta información se puede obtener por espectrometría de masas o de un libro de referencia.

3. Multiplique la masa atómica de cada isótopo por su proporción en la muestra. En una muestra que contiene carbono-12 y carbono-13, si el 99 por ciento de la muestra es carbono-12, multiplique 12 por 0,99 y 13 por 0,01.

4. suma los resultados. El total es la masa atómica relativa, o peso atómico, de la muestra.
Consejos
- Algunos isótopos son menos estables que otros y se descomponen en elementos con menos protones y neutrones en sus núcleos mientras repelen partes de sí mismos. Estos isótopos se llaman radiactivos.
Artículos de primera necesidad
- Espectrómetro de masas
- libro de referencia quimica
- Calculadora
Artículos sobre el tema. "Calcular la masa atómica"
Оцените, пожалуйста статью
Popular