Por ejemplo, en la molécula de NaCl (cloruro de sodio), el átomo de cloro tiene una electronegatividad bastante alta y el sodio una electronegatividad bastante baja. Como resultado, los electrones serán atraídos hacia el cloro y lejos del sodio. 
Esta es un enlace a una excelente tabla de electronegatividad. Tenga en cuenta que esto representa la electronegatividad según la escala de Pauling, la escala más utilizada. Sin embargo, existen otras formas de medir la electronegatividad, una de las cuales se mostrará a continuación. 
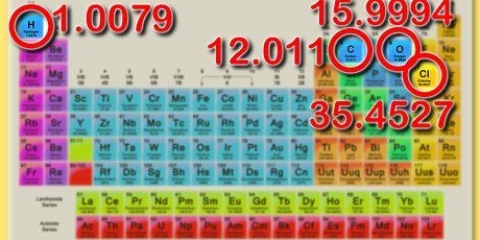
La electronegatividad de un átomo es más alto si vas derecho se mueve en la tabla periodica. La electronegatividad de un átomo es más alto si te levantas se mueve en la tabla periodica. Los átomos en la parte superior derecha tienen la electronegatividad más alta y los átomos en la parte inferior izquierda la más baja. Por ejemplo, en el ejemplo anterior con NaCl, sabes que el cloro tiene una electronegatividad más alta que el sodio porque está casi en la parte superior derecha del sistema. Por otro lado, el sodio está muy a la izquierda, lo que lo convierte en un átomo de menor valor. 

Por ejemplo: la molécula O2 tiene ese tipo de enlace. Como los dos átomos de oxígeno tienen la misma electronegatividad, la diferencia entre ellos es 0. 
Un buen ejemplo de esto es la molécula H2O (agua). El O es más electronegativo que los dos H, lo que hace que se una más estrechamente a los electrones, lo que hace que toda la molécula sea parcialmente negativa en el átomo de O y parcialmente positiva en los átomos de H. 
Un ejemplo de esto es el NaCl (cloruro de sodio). El cloro es tan electronegativo que atrae los dos electrones del enlace hacia sí mismo, dando al sodio una carga positiva. 
La mayoría de los átomos a la izquierda y al centro de la tabla periódica son átomos. Éste la página tiene una tabla que indica qué elementos son metales. El ejemplo de HF mencionado anteriormente cae en esta categoría. Como H y F no son metales, tienen un covalente polar vínculo. 

La afinidad electrónica de y o litio es 60 KJ mol. 
En nuestro ejemplo lo resolvemos de esta manera:
Cálculo de electronegatividad
Contenido
En química, la electronegatividad es una medida de la fuerza con la que un átomo atrae los electrones en un enlace atómico. Un átomo con electronegatividad alta atrae electrones con más fuerza, mientras que un átomo con electronegatividad baja los atrae débilmente. Los valores electronegativos se utilizan para predecir cómo se comportarán los diferentes átomos en un enlace, lo que hace de esta una habilidad importante para la química básica.
Pasos
Método 1 de 3: Fundamentos de electronegatividad

1. Comprender que los enlaces químicos se forman cuando los átomos comparten electrones. Para comprender la electronegatividad, es importante comprender primero qué es un `enlace`. Todos los átomos en una molécula que están `enlazados` entre sí en un diagrama molecular tienen un enlace atómico. Básicamente, esto significa que comparten dos electrones: cada átomo contribuye con un electrón al enlace.
- El exacto las razones por las que los átomos comparten electrones y forman un enlace son demasiado para este artículo. Si quieres aprender más sobre esto, lee Este artículo sobre los conceptos básicos de un enlace atómico, o los propios artículos de wikiHow sobre el tema.

2. Comprender el efecto de la electronegatividad en los electrones en el enlace. Cuando dos átomos comparten dos electrones en un enlace, no comparten por igual. Cuando un átomo tiene una electronegatividad más alta que el átomo al que está unido, atrae a los dos electrones del enlace más cerca de sí mismo. Un átomo con una electronegatividad muy alta puede atraer los electrones hasta su lado del enlace, de modo que los electrones apenas se comparten con el otro átomo.

3. Use una tabla de electronegatividad como referencia. Una tabla de elementos de electronegatividad tiene los elementos ordenados de la misma manera que en una tabla periódica, excepto que en este caso cada átomo está etiquetado con su electronegatividad. Puede encontrarlos en muchos libros de texto y artículos técnicos, pero también en línea.

4. Recuerde que la electronegatividad se presta a estimaciones rápidas. Si no tiene una tabla de electronegatividad a mano, aún puede estimar la electronegatividad de un átomo en función de dónde se encuentra en la tabla periódica. Como regla general:
Método 2 de 3: encontrar enlaces con electronegatividad

1. Encuentre la diferencia de electronegatividad entre los dos átomos. Cuando dos átomos forman un enlace, la diferencia en su electronegatividad puede brindarle más información sobre la calidad de su enlace. Resta la electronegatividad más pequeña de la más grande para encontrar la diferencia.
- Por ejemplo, si observamos la molécula HF, restamos la electronegatividad del hidrógeno (2.1) del flúor (4.0). 4.0 - 2.1=1.9

2. Si la diferencia es menor a 0.5, entonces el enlace es covalente apolar. Los electrones se comparten casi completamente por igual. Estos enlaces no forman moléculas con grandes diferencias de carga en ambos lados. Los enlaces no polares suelen ser muy difíciles de romper.

3. Si la diferencia está entre 0,5 y 1,6, entonces el enlace es covalente polar. Estos enlaces tienen más electrones en un extremo que en el otro. Esto hace que la molécula sea un poco más negativa en el lado con los electrones y un poco más positiva en el lado sin electrones. El desequilibrio de carga en estos enlaces permite que la molécula participe en ciertas reacciones especiales.

4. Si la diferencia es mayor a 2.0, entonces el enlace es iónico. En estos enlaces, los electrones están completamente en un extremo del enlace. El átomo más electronegativo gana carga negativa y el átomo menos electronegativo gana más carga positiva. Estos tipos de enlaces permiten que los átomos asociados reaccionen bien con otros átomos e incluso que los átomos polares los separen.

5. Si la diferencia está entre 1,6 y 2,0, compruebe si hay algún metal presente. Sí hay bien un metal está presente en el enlace, entonces el enlace es iónico. Si solo hay no metales en él, entonces el enlace es covalente polar
Método 3 de 3: determinar la electronegatividad de Mulliken

1. Encuentre la primera energía de ionización del átomo. La electronegatividad de Mulliken es una forma ligeramente diferente de medir la electronegatividad que la utilizada en la tabla de Pauling anterior. Para encontrar la electronegatividad de Mulliken de un átomo en particular, primero debe encontrar la energía de ionización de ese átomo. Esta es la energía requerida para hacer que el átomo descargue un solo electrón.
- Esto es algo que probablemente tendrá que buscar en los libros de referencia de química. Éste el sitio tiene una buena tabla que podría usar (desplácese hacia abajo para encontrarla).
- Un ejemplo: Supongamos que queremos determinar la electronegatividad del litio (Li). En la tabla del sitio anterior leemos que la primera energía de ionización es igual a 520 kJ/mol.

2. Encuentre la afinidad electrónica del átomo. Esta es una medida de la energía ganada cuando se agrega un electrón a un átomo para crear un ion negativo. Nuevamente, esto es algo que tendrá que buscar en un libro de referencia. Éste el sitio tiene recursos que quizás desee consultar.

3. Resuelva la electronegatividad de Mulliken con la ecuación. Usando kJ/mol como unidad de energía, la ecuación de electronegatividad de Mulliken es igual a YMulliken=(1.97×10)(EI+micada uno) + 0.19. Incorpora tus valores a la ecuación y resuelve ANDMulliken.
- YMulliken=(1.97×10)(EI+micada uno) + 0.19
- YMulliken=(1,97×10)(520 + 60) + 0,19
- YMulliken=1,143 + 0,19=1.333
Consejos
- Además de las escalas de Pauling y Mulliken, existen otras escalas de electronegatividad, incluidas la de Allred-Rochow, la de Sanderson y la de Allen. Todos estos tienen sus propias ecuaciones para calcular la electronegatividad (algunas de las cuales pueden volverse bastante complejas).
- Electronegatividad no tiene unidades.
Artículos sobre el tema. "Cálculo de electronegatividad"
Оцените, пожалуйста статью
Popular